简介
使用荧光显微镜可以研究肿瘤形成和进展过程中组织及细胞内部发生的变化。像活细胞成像这样的技术对更加深入地了解肿瘤进展和转移是至关重要的。
在真核细胞中,由中空微管组成的有丝分裂纺锤体,有助于构建复制细胞的细胞骨架结构,并在有丝分裂过程中将复制的染色体从原始细胞中分离出来。在尤文肉瘤这一类的肿瘤细胞中,有丝分裂障碍的触发因子可通过检查有丝分裂纺锤体的机能障碍来得以确认[1]。
肉瘤是肌肉或骨骼等结缔组织中形成的一类肿瘤。尤文肉瘤和横纹肌肉瘤,分别生长于骨骼和肌肉中,是一种倾向于发生在骨骼生长活跃区域附近的儿科肿瘤。除了手术和化疗之外,电离辐射也被用于治疗这类肿瘤,但这可能会导致生长中的骨骼受到永久性损伤,包括不对称生长停滞、胫骨畸形及骨折概率增加等。骨骼损伤的严重度在很大程度上与骨骼接受的辐射剂量成正比。因此,我们有理由认为,选择性放射致敏肿瘤组织的策略可降低实现局部控制所需的辐射剂量,并能最大限度降低对邻近健康组织造成的间接损伤。
运用体外研究和小鼠异种移植模型系统,对使用mRNA合成抑制剂光神霉素A预处理,可以通过改变辐射损伤的转录反应实现选择性放射致敏EWS:Fli1+肿瘤细胞的假设进行了验证[2]。结果表明,光神霉素A可以通过抑制参与DNA损伤修复相关基因的转录,使EWS:Fli1+细胞在体内外显著放射增敏,导致肿瘤细胞程序性死亡[2]。
使用THUNDER Imager Tissue和Large Volume Computational Clearing(LVCC)可以揭示肉瘤细胞中有丝分裂纺锤体的更多细节,协助癌症研究人员获得更有用的见解。
挑战
在有丝分裂纺锤体成像中,可对其实现快速成像,并获得清晰的高对比度3D成像,以清晰展示重要细节的解决方案最为实用。传统的宽场显微成像速度快,检测灵敏度高,但不幸的是对于厚样本的成像通常会出现失焦不清晰或模糊的情况,这会降低对比度[3]。要阐明有丝分裂的不稳定性在癌症等复杂疾病中的作用,这需要在同一样本中进行多个关联生物学标记。
方法
该研究中使用了尤文肉瘤细胞(SK-ES-1)。对这些细胞进行α-微管蛋白(Clone YL1/2 Thermo-Fisher Scientific # MA1-80017,按1:500比例稀释/ Dylight 488偶联驴抗大鼠 Thermo-Fisher Scientific #SA5-10026)、γ-微管蛋白(Clone TU-30,AbCam # ab27074,按1:200比例稀释/Dylight 550偶联驴抗小鼠 Thermo-Fisher Scientific # SA5-10167)和DNA(Hoechst 33342蓝)进行染色。染色后,使用介质ProLong Glass Antifade(Thermo-Fisher Scientific #P36981)进行盖玻片封片,并通过使用63×/1.4 NA(数值孔径)的油镜进行THUNDER Imager Tissue成像。图像采集使用大体积成像解析(LVCC)[3]模式,并生成最大化投影图像数据。
结果
在有丝分裂过程中,α-微管蛋白(绿色)形成有丝分裂纺锤体,染色单体(蓝色)会附着在有丝分裂纺锤体上,而γ-微管蛋白(红色)集中定位在分裂细胞中的纺锤极上。通过THUNDER技术可观察到肉瘤细胞中有丝分裂纺锤体的更多细节。清晰的图像可以展示清晰的结构,以便进行分割和进一步的分析。
结论
THUNDER Large Volume Computational Clearing(LVCC)[3]进行尤文肉瘤细胞中的有丝分裂纺锤体成像时可显著增强对比度。与传统的宽场成像相比,其可展示细胞中有丝分裂纺锤体的更多细节。
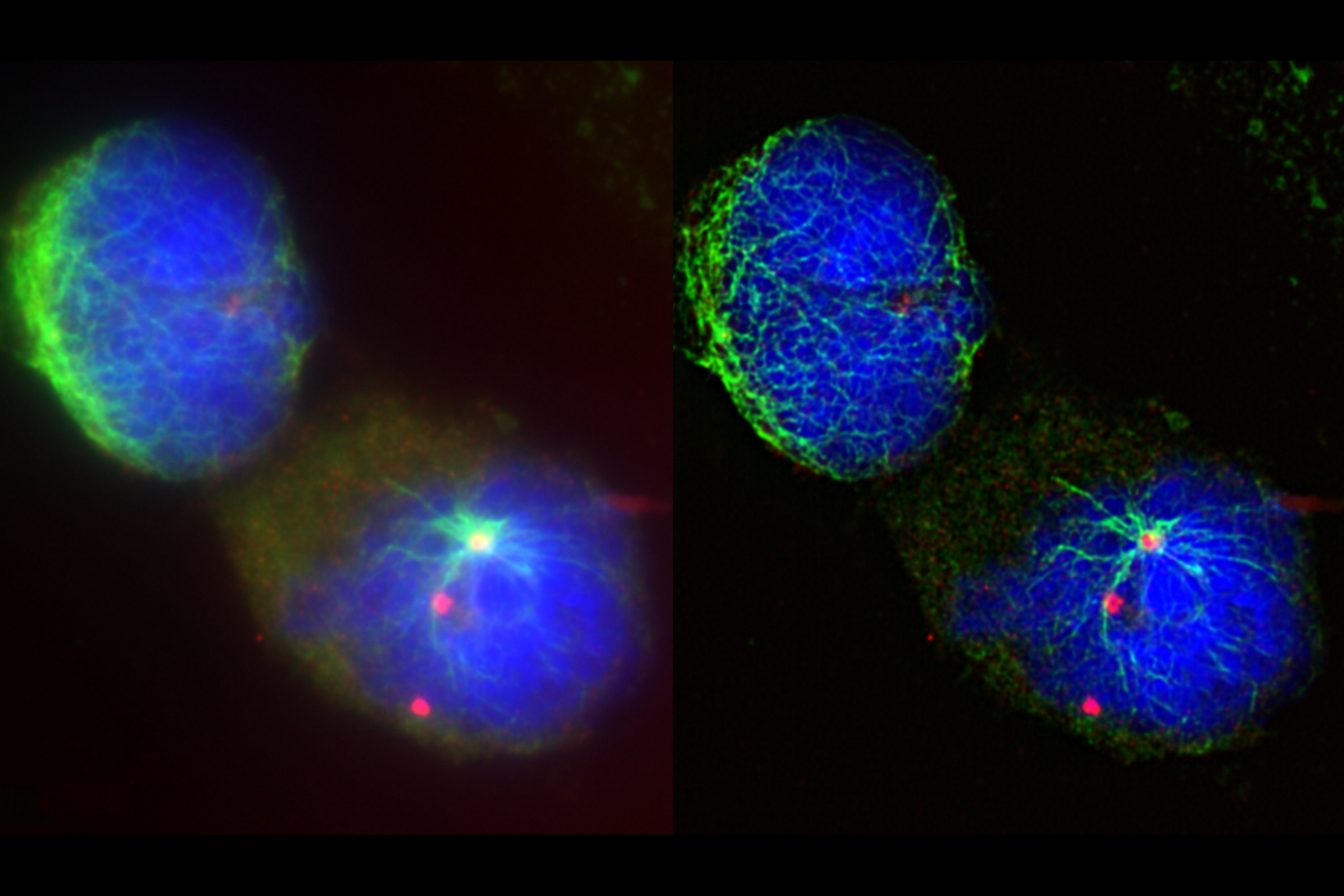
![[Translate to chinese:] Raw widefield (left) and THUNDER (right) image of Ewing Sarcoma cells (SK-ES-1) [Translate to chinese:] Raw widefield (left) and THUNDER (right) image of Ewing Sarcoma cells (SK-ES-1). Tubulin_mitotic_spindle_teaser.jpg](/fileadmin/_processed_/6/0/csm_Tubulin_mitotic_spindle_teaser_0c19fc12ae.jpg)
![[Translate to chinese:] Maximum intensity projection of Ewing Sarcoma cells (SK-ES-1) [Translate to chinese:] Maximum intensity projection of Ewing Sarcoma cells (SK-ES-1)](/fileadmin/_processed_/d/8/csm_Ewing_Sarcoma_cells_6cc0f1d387.jpg)
![[Translate to chinese:] Raw widefield and THUNDER image of calcium transients in Drosophila embryos. Courtesy A. Carreira-Rosario, Clandinin laboratory, California, USA. [Translate to chinese:] Raw widefield and THUNDER image of calcium transients in Drosophila embryos. Courtesy A. Carreira-Rosario, Clandinin laboratory, California, USA.](/fileadmin/_processed_/7/6/csm_Calcium_transients_in_Drosophila_embryos_teaser_51305d161e.jpg)