Während die überwiegende Mehrheit der Bildgebungsexperimente die Intensität der Fluoreszenz misst, nutzt FLIM eine andere wichtige Eigenschaft der Fluoreszenz, um der Forschung eine reichhaltige Informationsquelle hinzuzufügen - ihre Lebensdauer. Ein fluoreszierender Farbstoff hat neben seines charakteristischen Emissionsspektrums und auch eine Fluoreszenzlebensdauer, die widerspiegelt, wie lange der Farbstoff im angeregten Zustand bleibt. Der Kontrast eines FLIM-Bildes hängt von der Lebensdauer und nicht von der Intensität des Fluoreszenzsignals ab. Diese Lebensdauerinformationen können wertvolle neue Erkenntnisse für Experimente liefern, da sie von der Mikroumgebung des Farbstoffs abhängen.
Bis vor kurzem galt die Lebensdauer-Bildgebung als zu langsam, komplex und teuer für den täglichen Einsatz in der Mikroskopie, insbesondere für solche, die die Bildgebung lebender Zellen erfordern. Aber das hat sich grundlegend geändert. Mit den heutigen fortschrittlichen Technologien ist die Lebensdauer-Bildgebung schneller und einfacher zu bedienen als je zuvor.
Lebensdauerinformationen sind unabhängig von der Fluorophorkonzentration, daher kann FLIM in Bezug auf die Untersuchung der molekularen Funktion, Interaktionen und Umgebung sehr nützlich für die funktionelle Bildgebung sein. Biosensoren können ebenfalls mit FLIM genutzt werden, um zelluläre Mikroumgebungen zu untersuchen. FLIM kann verwendet werden, um Fluoreszenzsonden zu unterscheiden, die überlappende Emissionsspektren haben, und um unerwünschte Hintergrundsignale zu eliminieren.
Auf dieser Seite finden Sie einen Leitfaden zu allen Fragen, die Sie möglicherweise über FLIM haben, mit Links zu relevanten Artikeln für weitere Informationen. Erfahren Sie mehr über die Grundlagen von FLIM.
Was sind die Anwendungen der FLIM-Mikroskopie?
FLIM liefert Informationen, die normalerweise nicht mit reinen Intensitätsdaten verfügbar sind. Lebensdauerinformationen können Naturwissenschaftlern helfen, verschiedene Fluorophore in einer Probe zu unterscheiden, auch wenn sie überlappende Emissionsspektren haben. Die Fluoreszenzlebensdauer ist im Gegensatz zur Intensität unabhängig von der Molekülkonzentration, aber sie hängt von der Mikroumgebung des Farbstoffs ab, so dass FLIM es ermöglicht, dynamische Veränderungen der lokalen Umgebungsbedingungen in einer Probe zu überwachen.
Einige beliebte Anwendungen, bei denen FLIM dazu beitragen kann, neue Erkenntnisse zu gewinnen, sind:
- Erforschung der zellulären Mikroumgebung mit umweltsensitiven Fluoreszenzsonden, mit denen sich Veränderungen von Temperatur, Ionenkonzentration, pH-Wert, Polarität, Viskosität und sekundären Botenstoffen verfolgen lassen.
- Charakterisierung verschiedener Gewebetypen durch Autofluoreszenz.
- Analyse des Stoffwechsels und der mitochondrialen Dysfunktion in lebenden Zellen, Geweben und Organismen mit label-freien Experimenten.
Biomedizinische Forschungsanwendungen mit FLIM in Kombination mit Förster-Resonanzenergietransfer (FRET) haben sich auch zur Untersuchung dynamischer Veränderungen in Zellen als vorteilhaft erwiesen. FRET ermöglicht es, molekulare Wechselwirkungen wie die zwischen Liganden und Rezeptoren, Proteinen oder Effektoren und DNA zu überwachen.
In jüngsten Forschungen zu Diabetes mittels FLIM wurde die defekte Aufrechterhaltung normaler Blutzuckerspiegel durch eine Funktionsstörung der Alpha- und Beta-Zellen in den Inseln untersucht. Multiphotonen-Phasor-FLIM-NADH-Autofluoreszenzbildgebung wurde eingesetzt, um Stoffwechselveränderungen lebender Inselzellen vor und nach Glukosestimulation zu erkennen. Nach Glukosestimulation wurden bei gesunden Inseln mit Phasor-FLIM eine erhöhte oxidative Phosphorylierung in den Beta-Zellen und eine unterdrückte oxidative Phosphorylierung in den Alpha-Zellen beobachtet, aber diese wurden bei Inseln mit Typ-2-Diabetes nicht beobachtet.
Es gibt verschiedene Möglichkeiten, wie FLIM Informationsgehalt zu Ihren aktuellen konfokalen Experimenten hinzufügen kann. Dazu gehören die Verringerung der Wahrscheinlichkeit von Artefakten in Ihrem Bild, die Unterscheidung des wahren Signals von unerwünschter Autofluoreszenz und die sichere Unterscheidung von mehr Fluorophoren.
Wieso passen FLIM und FRET so gut zusammen?
Fluoreszenz ist die spontane Emission eines Photons aus einem Molekül oder Atom nach Absorption von Licht. Wenn zwei fluoreszierende Moleküle (Fluorophore) sehr nahe beieinander liegen, nur wenige Nanometer voneinander entfernt, kann die Energie direkt von einem "Donor"-Fluorophor auf einen "Akzeptor"-Fluorophor übertragen werden, ohne dass es zu einer Lichtemission kommt. Dieser direkte Energieaustausch wird als Förster-Resonanzenergietransfer (FRET) bezeichnet.
Das Auftreten von FRET zeigt sich durch mehrere Phänomene. Zunächst wird die Probe (der Akzeptor) eine Fluoreszenzfarbe emittieren, die nicht aus der verwendeten Anregungsfarbe zu erwarten ist. Diese Emission kann gemessen und mit der ursprünglichen Emission verglichen werden; eine Methode, die als "sensibilisierte Emission" bekannt ist. Die sensibilisierte Emission weist in quantifizierbarer Weise auf das Auftreten von FRET hin.
Im Gegenzug nimmt die Emission des Donors ab, da einige der angeregten Zustände in Akzeptoranregungen übergehen. Dieses Phänomen wird in einer Methode namens " Acceptor Photobleaching" ausgenutzt, bei der die Veränderung der Donor-Emission nach der Beseitigung des Akzeptors durch Photobleaching gemessen wird. Nachdem der Akzeptor entfernt wurde, nimmt die Donor-Emission zu.
Je größer die Überlappung der Emissionsspektren der Fluorophore, desto wahrscheinlicher ist es, dass FRET auftritt. Sogar die Ausrichtung der Moleküle beeinflusst den Transfer. FRET kann genutzt werden, um molekulare Wechselwirkungen zu erkennen und zu untersuchen, wie beispielsweise zwischen Liganden und Rezeptoren, Proteinen oder Effektoren und Nukleinsäuren in Zellen.
Intensitätsbasierte FRET-Methoden sind sehr anfällig für Schwankungen des Fluorophorgehalts im Probenmaterial, Moleküldiffusion, Bewegungen der Probe und Schwankungen in der Anregung. Glücklicherweise bietet die Kombination aus FLIM und FRET einen großen Vorteil, um solche Einschränkungen zu überwinden. Wenn FRET auftritt, gibt es eine deutliche Abnahme der Fluoreszenzlebensdauer des Donors, die sogar als Maß für die FRET-Effizienz dienen kann.
Welche Tools und Techniken können für FLIM verwendet werden?
Das STELLARIS 8 FALCON von Leica Microsystems öffnet die Tür für das Biosensing und der Verfolgung von Wechselwirkungen zwischen Proteinen, wobei FLIM-Informationen jetzt für alle Modalitäten verfügbar sind. Dieses innovative, integrierte System ermöglicht es Forschern, schnelle molekulare Wechselwirkungen über FLIM-FRET zu verfolgen, Biosensoren zur Erkennung von Veränderungen im Stoffwechselzustand und Mikroumgebung zu verwenden und die Lebensdauerkontraste zur Trennung mehrerer Fluorophore anzuwenden. Darüber hinaus bietet die STELLARIS 8 FALCON-Lösung Forschern die Möglichkeit, FLIM-Daten mit minimalem Training zu erfassen.
Die Lösung bietet eine neue Dimension des Bildkontrasts aus der Fluoreszenzlebensdauer, welche das Biosensing und die Überwachung selbst schneller molekularer Wechselwirkungen über FLIM-FRET ermöglicht. Es erlaubt auch Forschern, Biosensoren zur Erkennung von Veränderungen im Stoffwechselzustand und Zellumgebung zu nutzen und Lebensdauerkontraste zur Trennung von Fluorophoren anzuwenden.
Die Analyse mit FLIM-Phasoren bietet eine 2D-Visualisierung von Lebensdauerkomponenten. Der Phasor-Ansatz erfordert kein Fitting. Die graphische Ansicht von FLIM-Phasoren ermöglicht es jedem Beobachter, verschiedene Lebensdauer-Populationen schnell zu unterscheiden und zu trennen, und die Interpretation der Verteilungen ist unkompliziert. Mehrere molekulare Spezies werden innerhalb eines einzigen Pixels aufgelöst, da jede Spezies einen spezifischen Phasor hat. FLIM-Phasoren ermöglichen es, Veränderungen in der Zellumgebung zu verfolgen, Komponenten für die Signalmultiplexing auszuwählen und die FRET-Effizienz zu bestimmen.
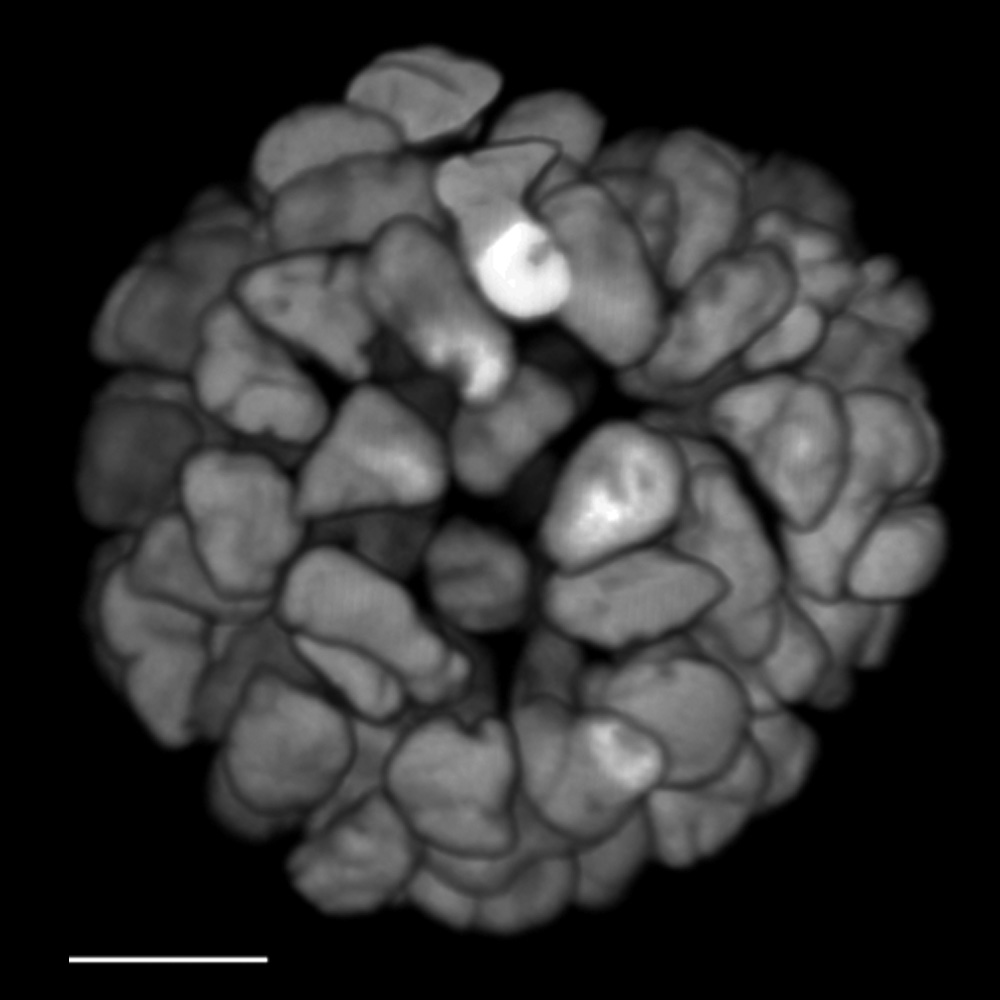
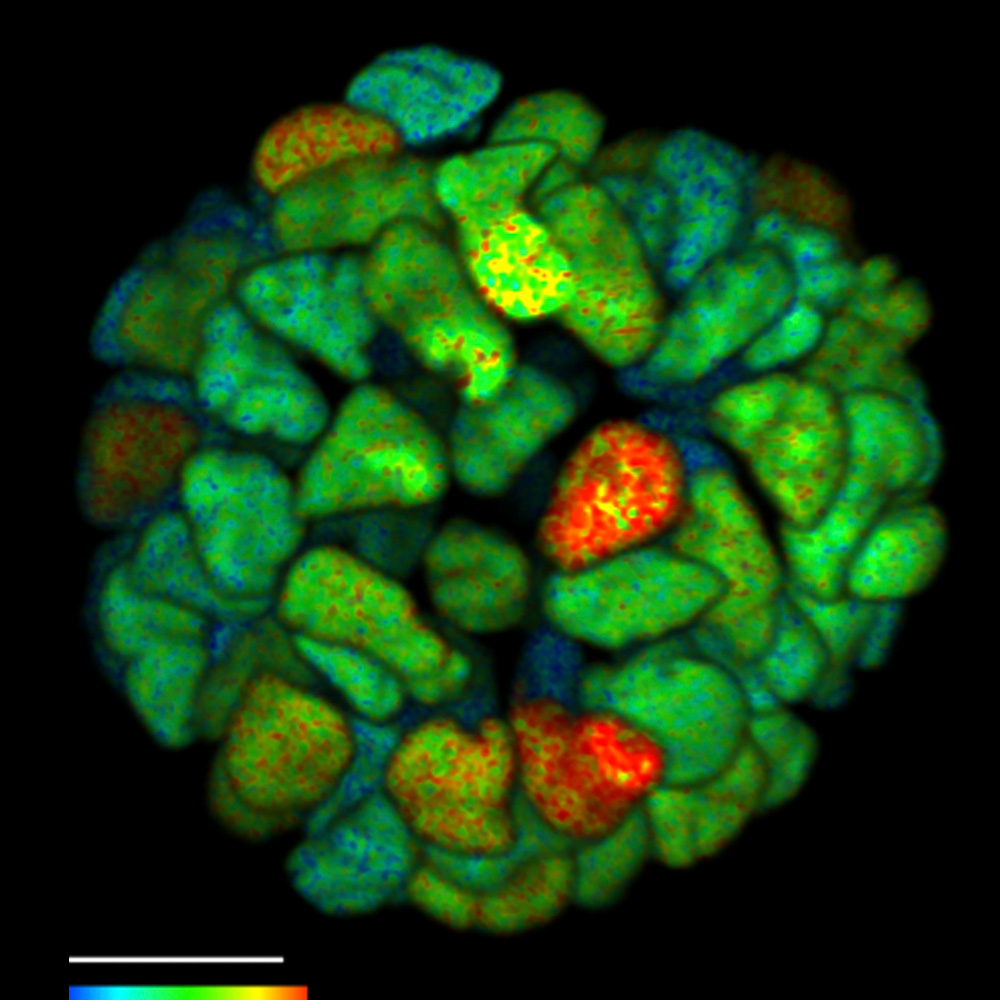
FLIM an einem lebenden 3D-Organoid von Krebspatienten. Überwachung der durch Krebs verursachten Zunahme der Signaltransduktionsaktivität in lebenden Organoiden mit einem ERK FRET-FLIM Biosensor.
Welche neuesten Fortschritte gibt es in der FLIM-Technologie?
Video-Rate-FLIM mit Pixel-für-Pixel-Quantifizierung ist durch die schnelle Elektronik und der empfindlichen spektralen Hybrid-Detektoren des STELLARIS 8 FALCON-Systems erreichbar. Photonenankunftszeiten werden mit Zählraten aufgezeichnet, die für die Standard-Konfokalbildgebung typisch sind. Das System hat eine extrem kurze Totzeit und leistungsstarke integrierte Algorithmen für die Datenerfassung und -analyse. Traditionelle Time-Correlated-Single-Photon-Counting (TCSPC)-Lösungen sind intrinsisch langsam und schwierig zu implementieren, so dass FLIM-Bildgebung auf Experten beschränkt war und nicht in der Lage war, die für die Untersuchung biologischer Prozesse erforderliche Geschwindigkeit im Sekundenbereich zu liefern.
Um schnelle Ergebnisse zu erzielen, wurde die Lebensdauerbildgebung nahtlos in die vollständigen spektralen, flexiblen Konfokalbildgebungs- und Verarbeitungswerkzeuge der STELLARIS 8 FALCON-Plattform integriert. Die Lebensdauerinformationen werden als zusätzlicher Kontrastkanal eines typischen Konfokalbildes aufgezeichnet. Daher ist die Aufzeichnung von FLIM-Daten jetzt so einfach wie das Drücken einer Taste.
Die einzigartige TauSense-Technologie von STELLARIS ermöglicht es Ihnen, aus jeder Probe eine zusätzliche Ebene an Informationen zu extrahieren und den wissenschaftlichen Einfluss Ihrer Forschung zu erhöhen. TauSense besteht aus anwendungsorientierten Bildgebungswerkzeugen auf der Grundlage der Fluoreszenzlebensdauer, die Sie nutzen können, um die Funktion von Molekülen im zellulären Kontext zu erforschen:
- TauContrast > bietet Zugang zu funktionellen Informationen wie Stoffwechselstatus, pH-Wert und Ionenkonzentration.
- TauGating > entfernt unerwünschte Fluoreszenzbeiträge.
- TauSeparation > erweitert die Kombination von fluoreszierenden Signalen über die spektralen Optionen hinaus.
- TauInteraction > ermöglicht eine einfache Detektion und Quantifizierung von molekularen Interaktionen (z. B. Protein-Protein-Interaktionen).
Weitere Einzelheiten über Tausense finden Sie auf Nature Methods: Application Note: TauSense: the potential of STELLARIS
FLIM FAQ
Mit FLIM können dynamische Veränderungen in zellulären Umgebungen verfolgt werden. So können beispielsweise Interaktionen zwischen Proteinen und anderen Biomolekülen wie Liganden, Rezeptoren und Nukleinsäuren in einer lebenden Zelle mithilfe von FLIM überwacht werden.
FLIM kann nützlich sein, um den Autofluoreszenz-Hintergrund während der Bildgebung von Proben zu eliminieren. Lifetime-Messungen ermöglichen es, Autofluoreszenz von gewünschten Fluorophorsignalen zu unterscheiden. Diese Fähigkeit bedeutet, dass FLIM verwendet werden kann, um aussagekräftige Informationen aus fast jedem Fluoreszenzsignal zu sammeln, einschließlich Autofluoreszenz.
Biomedizinische Forscher sind oft daran interessiert, Ionen, Proteine, Biomoleküle und ihre Wechselwirkungen in lebenden Zellen zu überwachen, um dynamische Prozesse zu verstehen. FLIM ist ein besseres Verfahren zur Untersuchung zellulärer Dynamik als die Fluoreszenzintensitäts-basierte Methode. Die Lebensdauer ist unabhängig von der Fluorophorkonzentration, der Beleuchtungsintensität sowie der Lichtabsorption und -streuung.
Ähnliche Seiten
-

Konfokalmikroskope
Unsere Konfokalmikroskope für die biomedizinische Spitzenforschung bieten bildgebende Präzision für…
Visit related page -
![[Translate to German:] [Translate to German:]](/fileadmin/_processed_/5/e/csm_lms-life-science-fluorescence-header_0e351a388e.jpg)
Fluoreszenz
Die Fluoreszenz ist eines der am häufigsten verwendeten physikalischen Phänomene in der biologischen…
Visit related page -
![[Translate to German:] [Translate to German:]](/fileadmin/_processed_/e/b/csm_FLIM-Header-res_0537942540.jpg)
Fluoreszenzlebensdauer-Bildgebung
Die Fluoreszenzlebensdauer-Mikroskopie (FLIM) ist eine Bildgebungstechnik, die inhärente…
Visit related page
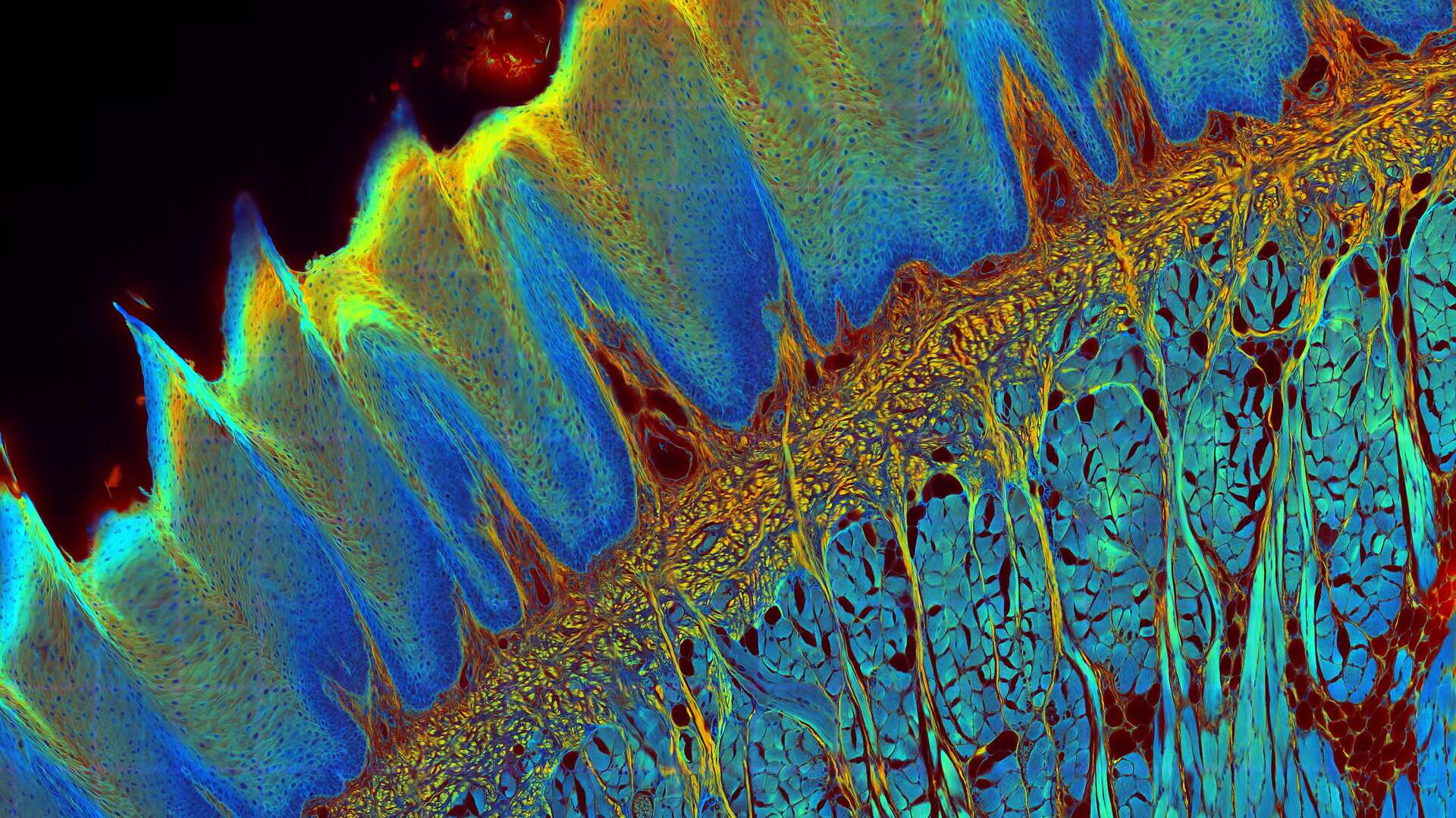
![[Translate to German:] Transverse histological cut of a rabbit tongue. 50 Mpixels images (2326 µm x 1739 µm) in 14 x 18 tiles. Lifetime gives an additional contrast that allows to differentiate different structures in histological stainings. [Translate to German:] Transverse histological cut of a rabbit tongue. 50 Mpixels images (2326 µm x 1739 µm) in 14 x 18 tiles. Lifetime gives an additional contrast that allows to differentiate different structures in histological stainings. lms-a-guide-to-flim_header_rabbit-tongue-Fast-FLIM.jpg](/fileadmin/_processed_/f/8/csm_lms-a-guide-to-flim_header_rabbit-tongue-Fast-FLIM_8a507e69b0.jpg)
