Aber was ist räumliche Biologie? Und wie können Forschende die neuen Mittel und Möglichkeiten nutzen, um dem wachsenden Forschungsbedarf im Bereich der Biologie in einer Post-Omics-Ära gerecht zu werden? In diesem Artikel geben wir einen kurzen Überblick über das Thema räumliche Biologie, die zugehörigen Technologien und Produkte sowie über relevante wissenschaftliche Fragestellungen.
Was ist räumliche Biologie?
Vereinfacht ausgedrückt ist räumliche Biologie die Kombination von räumlichen Informationen mit Informationen über die Eigenschaften biologischer Moleküle. Mit anderen Worten: Wenn Koordinateninformationen identifizierten biologischen Molekülen einer Probe zugeordnet werden, fallen die resultierenden Daten in den Bereich der räumlichen Biologie. Der Begriff wird jedoch in der Regel nur im großen Maßstab verwendet, d.h. wenn Tausende oder Millionen von Zellen, Proteinen, Transkripten oder anderen Analyten räumlich aufgelöst werden.
So fällt beispielsweise die Untersuchung eines einzelnen Proteins und seiner Lage innerhalb einer Zellkultur nicht in diesen Bereich, die Erforschung eines einzelnen Proteins im Kontext einer heterogenen Gewebeprobe unter hundert anderen Proteinen und RNA-Molekülen möglicherweise schon. Dies ermöglicht Forschenden, verschiedene biologische Analyten im Kontext der nativen Gewebearchitektur und der zellulären Mikroumgebung zu erforschen. Die räumliche Biologie kann somit die Vielfalt und räumliche Heterogenität der Zellbiologie in einem Gewebe neben der räumlichen Organisation von Zellen offenbaren.
Wie werden Daten im Bereich der räumlichen Biologie gewonnen?
Die drei wichtigsten Technologiefamilien zur Gewinnung von Daten im Bereich der räumlichen Biologie sind Fluoreszenzmikroskopie, Sequenzierung und Massenspektrometrie – oft auch eine Kombination aus allen drei Technologien. Spezifische Subtypen werden häufig durch die Basistechnologie definiert, der Positionsdaten hinzugefügt werden. Während beispielsweise die Verarbeitung von zusammenhängendem Organgewebe und die Sequenzierung von RNA-Molekülen aus den Lysaten oder der Einsatz von Einzelzell-Sequenzierung als Transkriptomik bezeichnet werden kann, wird der Einsatz von Mikrodissektionstechniken zur Zuweisung von RNA-Sequenzierungsdaten zu bestimmten physikalischen Orten häufiger als räumliche Transkriptomik bzw. räumlich aufgelöste Transkriptomik bezeichnet. Ansätze in der räumlichen Transkriptomik können auch die Hybridisierung von Barcode-Tags mit RNA-Molekülen in einer Probe und Einsatz von Direct Next Generation Sequencing oder Auswerten von Fluoreszenzsonden darstellen, um die Identität der gekennzeichneten Spezies aufzudecken. Alternativ kann auch DNA-in-situ-Sequenzierung in der räumlichen Biologie angewandt werden; eine Methode, die in den Bereich der räumlichen Genomik fällt. Hiermit können zum Beispiel Kopienzahlvariationen in Tumorzellen oder Änderungen der Chromosomenzahl in Geweben, die eine Aneuploidie – eine Abweichung der normalen Chromosomenmenge – aufweisen, untersucht werden.
Die Bestimmung der Proteine in dieser Probe mittels Massenspektrometrie würde als räumliche Proteomik oder räumlich aufgelöste Proteomik bezeichnet. Bei dieser Methode können Gewebebereiche mikrodisseziert und einer Massenspektrometrie unterzogen werden, bevor diese Bereiche wieder zu einem Referenzbild ausgerichtet werden. Alternativ ermöglichen verschiedene Bildgebungsverfahren die direkte Analyse von Gewebebereichen. Diese Techniken haben einen grundlegenden Ansatz gemein: Proben werden vorbereitet. Anschließend werden Bereiche des Gewebes ionisiert und Massenspektren generiert und analysiert, bevor sie mit der Position dieser Spektren innerhalb der Probe in Beziehung gesetzt werden.
Dieselben Methoden können auch quantitative räumliche Informationen über Nicht-Protein-Metaboliten liefern (allgemein als räumliche Metabolomik bezeichnet), obwohl die Analyten nicht notwendigerweise direkte Produkte des zellulären Metabolismus sein müssen. Mit diesen Ansätzen können Lipide (Lipidomik), Zucker (Glykomik) oder sogar Arzneimittelmoleküle analysiert werden, um die Pharmakodynamik zu beurteilen. Dies ist ein anspruchsvoller Ansatz, der stark von guten Messstandards abhängt, aber die Tür zu einem unglaublich breiten und tiefen Verständnis der Chemie des menschlichen Gewebes öffnet.
Multiplex-Bildgebung in der räumlichen Biologie
Räumliche Proteomik muss nicht allein auf Massenspektrometrie basieren. Es können auch Lichtmikroskopie und Multiplex-Bildgebung eingesetzt werden, um Dutzende oder Hunderte von Proteinen in einer Probe zu untersuchen. Das Massenspektrometrie- und das Multiplex-Bildgebungs-Verfahren sollen sich in Bezug auf die Komplexität, d.h. die Anzahl der Analyte, die in einer einzigen Probe analysiert werden können, unterscheiden. Das Verfahren zur Betrachtung weniger Moleküle kann als „Lowplex“ oder „Midplex“ bezeichnet werden, bei Hunderten oder Tausenden von Molekülen hingegen als „Highplex“. Wozu dienen Techniken für geringere Komplexität bei Experimenten im Bereich der räumlichen Biologie? Bildgebungsbasierte Verfahren bieten oft eine höhere Bildauflösung bei Gewebeaufnahmen. Wenn die Kenntnis der genauen Position eines Analyten in einer einzelnen Zelle wichtig ist, kann Multiplex-Bildgebung der einzige Weg sein, um das Ergebnis zu erzielen.
So interessieren sich Immunonkologie-Forschende häufig für die präzisen Zelltypidentitäten hochspezialisierter Immunzellsubtypen. Dies kann eine Auflösung auf Einzelzellebene von fünf bis zehn Biomarkern erfordern, damit ein genauer Phänotyp zugewiesen werden kann, was ein Verfahren mit höherer Auflösung und geringerer Komplexität erfordert. Lowplex-/Midplex-Techniken und Highplex-Techniken schließen sich gegenseitig nicht aus. Lowplex-Verfahren können zur Definition von Hypothesen und sogar bestimmter Geweberegionen eingesetzt werden, die später im Arbeitsablauf mit einer massenspektrometrischen oder sequenzierungsbasierten Highplex-Methode analysiert werden.
Welche Möglichkeiten eröffnet Multiplex-Bildgebung in der räumlichen Biologie? Es gibt viele Arbeitsabläufe in der Multiplex-basierten räumlichen Biologie, in denen eine Vielzahl von Technologien eingesetzt werden, z.B.:
- Parallele Färbung und Bildgebung
- Lowplex in einem Durchgang
- All-in-One-Omics-Lösungen
- Iterative Färbung
Weitere Informationen zu diesen Technologien unter Multiplexed Imaging Types, Benefits and Applications.
Anwendungsbeispiel: Tumor-Mikroumgebungen
Wozu können Forschende diese Techniken einsetzen? Der Wechsel zu räumlichen Ansätzen ergibt sich aus dem technologischen Fortschritt und einem tieferen Verständnis der biologischen Aktivitäten von Zellen und Geweben. Es wird immer einfacher, zu ermitteln, welche Transkripte, Proteine und Moleküle sich in den Zellen befinden, und Forschende möchten genauer wissen, wie diese Moleküle organisiert sind, insbesondere in heterogenem Gewebe und während Krankheitszuständen. Nehmen wir die Mikroumgebung eines Tumors: Umfangreiche Forschungsergebnisse haben viele der molekularen Determinanten der Onkogenese und der Krebsprogression offenbart. Mit diesem Wissen wurden viele Therapien entwickelt, die auf klassische Onkogene und onkogenetische Signalwege abzielen – mit gemischtem Erfolg. Ein vielversprechendes Feld sind Immuntherapien, mit denen das Immunsystem dazu angeregt wird, Tumorgewebe anzugreifen und zu zerstören. Es kann jedoch eine Herausforderung sein, festzustellen, welche Patientinnen und Patienten von – oft sehr teuren – Arzneimitteln profitieren.
Der Schlüssel zur Prognose, ob jemand auf ein immuntherapeutisches Medikament anspricht, liegt oft in der Anordnung des Gewebes und der Art der Zellen in unmittelbarer Nähe zum Tumor selbst. Wie nah befinden sich die Tumorzellen an den Blutgefäßen? Sind Immunzellen vorhanden bzw. nicht vorhanden, wodurch sich der Tumor von seiner Umgebung unterscheiden lässt? Verlassen diese Immunzellen den Tumorbereich oder dringen sie ein? Sind die Zellen im Stande, auf Tumoren zu reagieren, oder befinden sie sich in einem erschöpften Zustand? Weist der Tumor Heterogenität in der Gen- und Proteinexpression auf, die eine Differenzierung in verschiedene Stoffwechselsegmente zeigt? All diese Fragen können für die Prognose des Ansprechens auf eine Immuntherapie relevant sein und fallen alle in den Bereich der räumlichen Biologie.
Anwendungsbeispiel: Genetik und Entwicklung
Die klassische Krebsgenetik kann auch von Techniken aus der räumlichen Biologie profitieren. Eine Fragestellung könnte lauten: Wo befinden sich Zellen mit defekter DNA-Reparatur? Welche zellulären oder genotoxischen Insulte erzeugen diese Zellen, und welches räumliche Schadensmuster erzeugen bestimmte Genotoxine? Es gibt aber ebenfalls Anwendungen in anderen Bereichen. Zum Beispiel zeigen komplexe, sich entwickelnde Gewebe wie Haarfollikel-Stammzellen mit oft recht granulären Zellidentitäten, die je nach Phase des Haarlebenszyklus in verschiedene Nischen wandern. Diese Konstellationen im Bereich der Entwicklungsbiologie eignen sich gut für Ansätze aus der räumlichen Biologie. Tatsächlich kann jedes Experiment, das genaue Kenntnisse der zellulären Identität und Position erfordert, von Technologien aus der räumlichen Biologie profitieren.
Schlussfolgerung
Das Forschungsfeld der räumlichen Biologie bietet eine Reihe von Mitteln, Methoden und Analyseverfahren, die Omics-Technologien und Bildgebung kombinieren, um so ein tieferes Verständnis über die Organisation des menschlichen Gewebes zu gewinnen. Im Zuge der Weiterentwicklung dieser Technologien ergeben sich immer vielschichtigere Fragestellungen. Komplexe Bereiche in der Krebsbiologie, Medizin, Entwicklungsbiologie und darüber hinaus dürften von diesen technologischen Durchbrüchen enorm profitieren. Das richtige Verständnis der räumlichen Biologie erleichtert den Übergang zu diesen Methoden und sollte Forschende motivieren, diese neuen Ansätze zur Gewinnung von Erkenntnissen im Kontext ihrer aktuellen experimentellen Systeme und darüber hinaus in Erwägung zu ziehen.
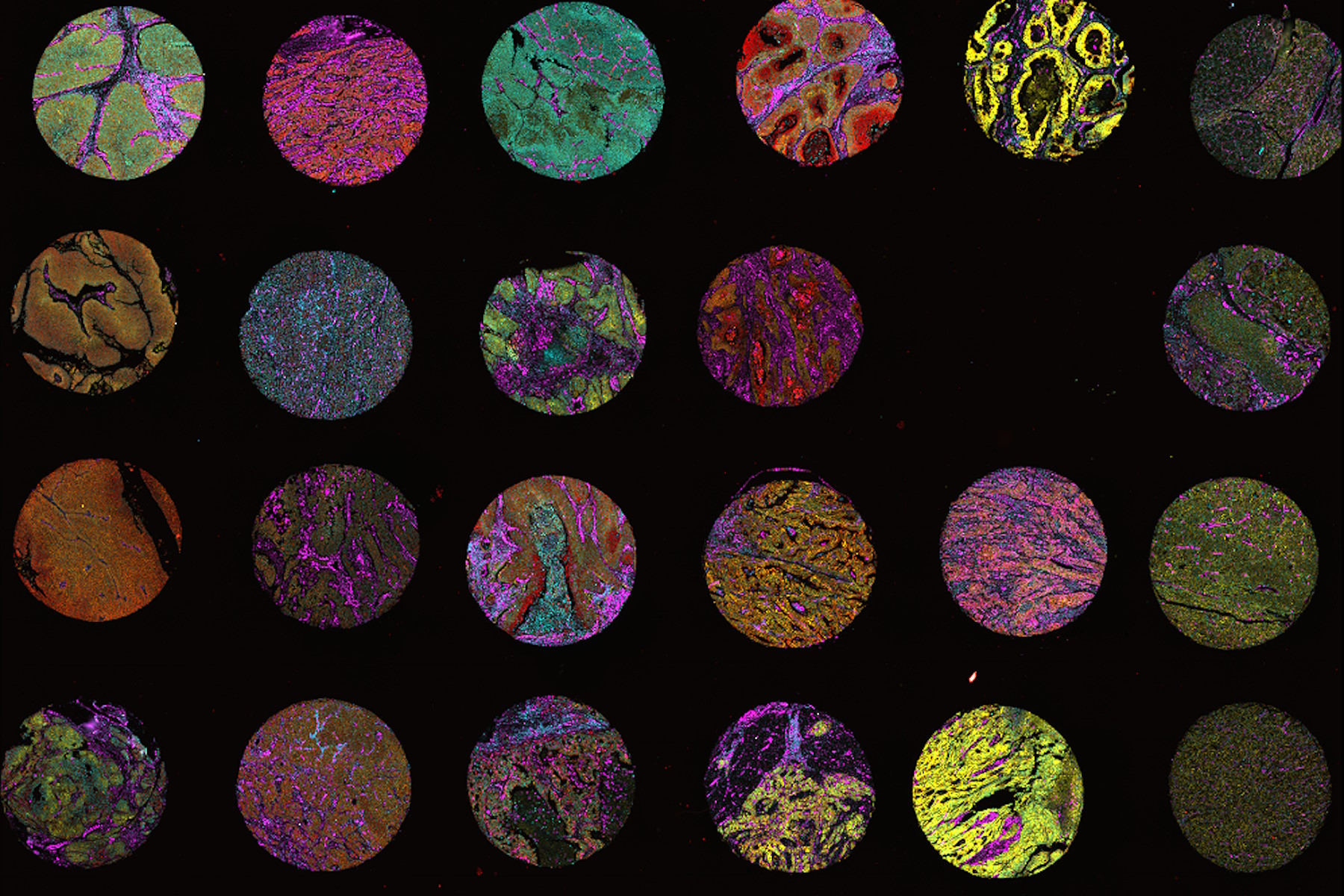
![[Translate to German:] Multi-tissue array with 4 markers shown including DAPI, NaKATPase, PanCk, and Vimentin. [Translate to German:] Multi-tissue array with 4 markers shown including DAPI, NaKATPase, PanCk, and Vimentin. Multi-tissue_array_with_4_markers.jpg](/fileadmin/_processed_/8/b/csm_Multi-tissue_array_with_4_markers_49880703bc.jpg)