Leica et le centre d'imagerie de l'EMBL - Création de réseaux ouverts
Tout au long de son histoire, Leica a établi avec enthousiasme des liens avec des établissements universitaires et de recherche scientifique afin de faire progresser la compréhension scientifique grâce à la microscopie. Désormais, grâce à notre partenariat spécial avec le Laboratoire européen de biologie moléculaire (EMBL) situé à Heidelberg, les chercheurs peuvent accéder à des technologies de préparation d'échantillons et d'imagerie de pointe.
En soutenant les efforts de l'EMBL pour mieux comprendre les bases moléculaires de la vie grâce à la mise à disposition des toutes dernières technologies et du soutien d'experts pour une vaste gamme de services scientifiques et expérimentaux, Leica aide les scientifiques à repousser les limites de leur recherche et à exploiter de meilleures connaissances.
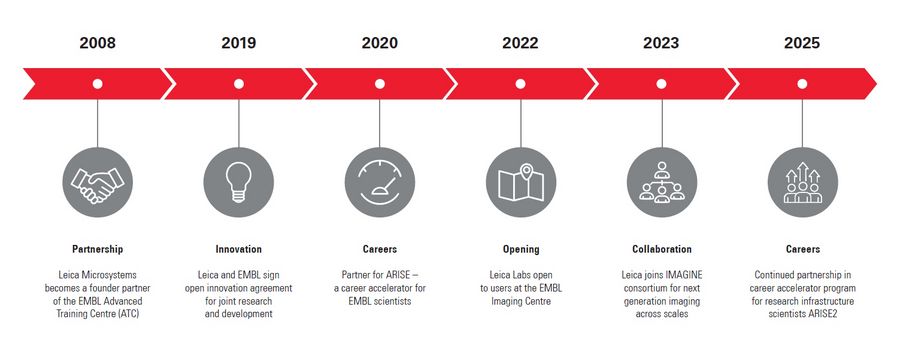
Leica compte parmi les quatre partenaires industriels ayant contribué à concrétiser la vision du Centre d'imagerie de l'EMBL, qui a officiellement ouvert ses portes en 2022.
Visitez le site Web du CI de l'EMBL pour découvrir les instruments mis à la disposition des candidats à la recherche.
Entretiens
Entretien avec Yassin Harim, doctorant au Centre allemand de recherche sur le cancer, Heidelberg
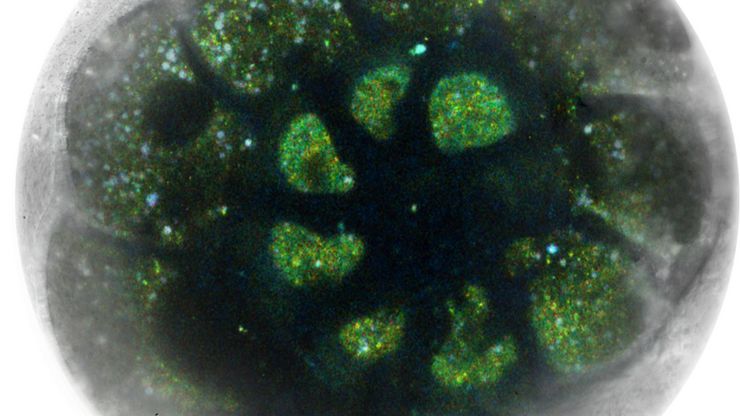
Découvrez l'imagerie 3D d'un cerveau entier de souris grâce à l'immunofluorescence multicolore ! Selon notre utilisateur invité du Centre allemand de recherche sur le cancer, l'utilisation de THUNDER Imager Live Cell au CI de l'EMBL était « ...la solution idéale pour obtenir des images de très haute qualité, mais également pour consacrer peu de temps à l'imagerie parce qu'il est extrêmement rapide à acquérir chaque diapositive individuelle ».
Interview with Virginia Pierini – Service Manager EMBL IC, Heidelberg. Virginia Pierini soutient l'exploitation du Centre d'imagerie de l'EMBL en ce qui concerne tous ses services, avec une attention particulière sur les utilisateurs. Elle est le point de contact du CI pour tous les utilisateurs, apportant son aide pour les procédures d'accès, l'exécution du projet et la formation des utilisateurs.
Entretien avec Virginia Pierini, responsable de service CI de l'EMBL, Heidelberg
Virginia Pierini soutient l'exploitation du Centre d'imagerie de l'EMBL en ce qui concerne tous ses services, avec une attention particulière sur les utilisateurs. Elle est le point de contact du CI pour tous les utilisateurs, apportant son aide pour les procédures d'accès, l'exécution du projet et la formation des utilisateurs.
Entretien avec Giorgia Susin, doctorante, Université de Trente, Italie
Giorgia Susin étudie le transport des ARN non codants dans les neurones de Xenopus laevis à l'aide du microscope STELLARIS pour dévoiler les interactions ARN-organites et améliorer la compréhension du transport de l'ARN. En réalisant une imagerie de super-résolution en temps réel avec TauSTED XTend pour une exposition minimale à la lumière, elle a préservé l'intégrité de l'échantillon tout en obtenant des informations haute résolution.
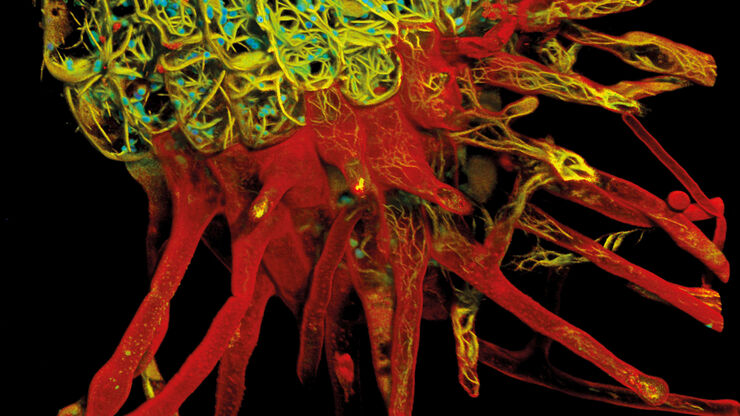
Le Centre d'imagerie de l'EMBL est équipé des derniers instruments de pointe de Leica et d'autres sociétés ainsi que de ceux développés par les groupes de recherche de l'EMBL.
Le CI de l'EMBL permet aux chercheurs d'accéder à des experts scientifiques issus du monde universitaire et de l'industrie, offrant ainsi à ses utilisateurs la possibilité de mener des travaux scientifiques de pointe grâce à une série d'outils et à un soutien qui ne sont pas accessibles à la plupart des scientifiques.
Les experts de Leica sont présents en permanence sur le site du CI de l'EMBL afin de permettre aux chercheurs d'utiliser les données de ses systèmes d'imagerie avancés afin de parvenir à des découvertes révolutionnaires.
Spécifications des produits
Trouvez des informations détaillées sur les produits pour les configurations présentées au Centre d'imagerie de l'EMBL
STELLARIS 8 STED Falcon et STELLARIS STED
- Cinq détecteurs à comptage de photons sensibles Power HyD à spectre réglable (2 HyD S, 2 HyD X, 1 HyD R)
- Confocal : lasers à lumière blanche réglable (WLL) 440-790 nm, déplétion STED 405 nm : 592 nm, 660 nm, 775 nm
- Scanner résonnant 8 kHz
- Temps mort total du système : 1,5 ns
- TauSTED Résolution réglable basée sur la durée de vie (en fonction de l'échantillon et du fluorophore) : <30 nm (latéral) et <100 nm (axial). Algorithme de suppression automatique d'arrière-plan basée sur la durée de vie. Réduction de la dose de lumière (excitation WLL) pour toutes les lignes STED (592, 660, 775 nm). Disponible pour la STED 2D et 3D dans des échantillons vivants et fixes, ainsi que pour des applications multicolores. Workflow automatisé intégré au logiciel LAS X.
- Les objectifs STED WHITE à immersion dans le glycérol et l'eau intégrant la technologie motCORR permettent une correction par optique adaptative des aberrations introduites par les inhomogénéités de l'échantillon et le décalage d'indice de réfraction. Les objectifs STED WHITE offrent une distance de travail de 300 µm :
- HC PL APO 86x/1.20 W motCORR STED WHITE
- HC PL APO 93x/1.30 GLYC motCORR STED WHITE
- HC PL APO 100x/1,40 OIL STED WHITE" (en anglais)
STELLARIS 8 DIVE Falcon
- Lignes laser IR: réglable 680 - 1080 nm et 680 - 1300 nm, fixe 1040 nm ; Confocal : Lasers à lumière blanche (WLL) 440 - 790 nm, 405 nm et 488 nm
- Quatre canaux NDD équipés de Power HyD X (réglable entre 380 et 800 nm), cinq détecteurs de comptage interne à spectre réglable (3 HyD S, 1 HyD X et 1 HyD R)
- Statif confocal fixe (DM6 CFS) équipé de la platine de balayage Scientifica
STELLARIS Cryo
- Tête de balayage STELLARIS avec 5 détecteurs HyD (2 HyD S, 2 HyD X, 1 HyD R)
- Unité d'alimentation laser avec laser super-continuum (440 - 790 nm) et une ligne laser à diode de 405 nm.
- Caméra sCMOS K5
- Microscope confocal droit à platine fixe DM6
- HC PL APO CRYO 50x/0,90 CLEM Objectif cryo
- Tourelle motorisée à 6 positions pour les travaux à température ambiante avec différents objectifs 10x - 100x
- Platine Märzhäuser équipée d'une platine Cryo ou d'un porte-échantillon pour l'imagerie RT et de plusieurs plages de course pour la cryogénie et la température ambiante.
Dewar de 25 l avec pompe cryogénique et unité de contrôle cryogénique
STELLARIS Cryo fait partie de la gamme Coral Cryo CLEM Workflow composé en outre de EM GP2 EM VCM plus EM Navette de transfert cryo VCT500 ou EM Métalliseur ACE600 plus EM Navette de transfert cryo VCT 500.
Microhub MICA
- Contraste de modulation intégré (IMC) et imagerie en lumière transmise sur fond clair en mode RVB ou échelle de gris
- ILLUMINATION FLUORESCENTE INCIDENTE LED 365 nm, 470 nm, 555 nm, 625 nm
- 4 canaux de détection simultanés à champ large avec démélange spectral FluoSync
- ILLUMINATION CONFOCALE Diode laser 405 nm, 488 nm, 561 nm, 638 nm
- 4 canaux de détection confocale simultanés (HyD FS) avec mélange spectral FluoSync
- CONTRÔLE DE L’ENVIRONNEMENT Température (température ambiante +3 °C à 45 °C), CO2 (0 - 10 %), humidité
- Distributeur d'eau en circuit fermé pour l'immersion des objectifs. L'immersion dans l'eau pour un objectif est contrôlée par rétroaction et ne nécessite aucune intervention de l'utilisateur
- Méthodes THUNDER : Instant Computational Clearing (ICC), Small Volume Computational Clearing (SVCC), Large Volume Computational Clearing (LVCC)
- Méthodes LIGHTNING Basic, LIGHTNING Expert
THUNDER Imager Live Cell
- Basé sur le microscope de recherche inversé haut de gamme entièrement motorisé DMi8
- Positionnement à haute vitesse avec la platine Quantum et le contrôleur en temps réel Synapse
- Éclairage à haute vitesse grâce à une source lumineuse LED multiligne
- Roue de filtres externe à commutation rapide
- Commande de mise au point adaptative (AFC) avec mise au point en boucle fermée
La chambre climatique assure des conditions physiologiques optimales pour les cellules vivantes
THUNDER Imager Live Cell fait partie du workflow CLEM pour cellules vivantes Coral Life, qui comprend le THUNDER Imager Live Cell, le congélateur à haute pression EM ICE et l'EM AFS2 pour la cryosubstitution automatique.
THUNDER Imager 3D Tissue
- Basé sur un microscope de recherche vertical entièrement automatisé pour l'acquisition d'images 3D multicolores
- Système de caméra sCMOS
- Le logiciel crée des vues d'ensemble sans flou de l'échantillon de tissu complet
- Commande motorisée précise de la mise au point z pour capturer des images dans la direction z et les visualiser avec la visionneuse 3D
EM GP2
- Température de travail réglable entre +4 °C et +60 °C
Humidité relative réglable jusqu'à 99 %
L'EM GP2 fait partie du workflow Coral Cryo CLEM composé de l'EM GP2, du STELLARIS 5 Cryo et de l'EM VCM plus navette de transfert cryo EM VCT500 ou métalliseur EM ACE600 plus navette de transfert cryo EM VCT 500.
EM ICE
- Module de stimulation électrique et lumineuse
Vidange automatique du Dewar LN2
L'EM ICE fait partie du workflow CLEM pour cellules vivantes Coral Life, qui comprend le THUNDER Imager Live Cell, le congélateur à haute pression EM ICE et l'EM AFS2 pour la cryosubstitution automatique.
EM ACE600
- Processus de dépôt de revêtement automatisé et basé sur des recettes
- Films de carbone de haute qualité en utilisant un dépôt de revêtement à fils ou crayons de carbone ou une évaporation sous faisceau électronique
Films précis, robustes et amorphes d'une épaisseur sub-namométrique
L'ACE600 fait partie du workflow Coral Cryo CLEM composé de l'EM GP2, du STELLARIS 5 Cryo et de l'EM VCM plus navette de transfert cryo EM VCT500 ou métalliseur EM ACE600 plus navette de transfert cryo EM VCT 500.
EM AFS2
EM FSP (robot de cryosubstitution), son système de manipulation automatique des réactifs
L'EM AFS2 fait partie du workflow CLEM pour cellules vivantes Coral Life, qui comprend également le THUNDER Imager Live Cell et le congélateur à haute pression EM ICE.
Apportez votre projet de recherche à l'EMBL et bénéficiez du soutien des spécialistes d'application de Leica Microsystems.

Robert Kirmse
Robert a obtenu son doctorat au DKFZ et à l'Université de Heidelberg. En tant que post-doctorant, il a travaillé sur l'invasion des cellules tumorales à BioQuant, Heidelberg et dans le domaine de la cryomocroscopie à l'Université du Colorado, Boulder. Il a rejoint Leica en 2019 en tant que responsable principal de la préparation des échantillons et chef de site à Vienne. Depuis octobre 2022, il dirige l'équipe du CI de l'EMBL de Leica pour l'innovation scientifique.
Robert Kirmse
Robert a obtenu son doctorat au DKFZ et à l'Université de Heidelberg. En tant que post-doctorant, il a travaillé sur l'invasion des cellules tumorales à BioQuant, Heidelberg et dans le domaine de la cryomocroscopie à l'Université du Colorado, Boulder. Il a rejoint Leica en 2019 en tant que responsable principal de la préparation des échantillons et chef de site à Vienne. Depuis octobre 2022, il dirige l'équipe du CI de l'EMBL de Leica pour l'innovation scientifique.

Andreia Pinto
Andreia a travaillé en tant qu spécialiste en microscopie électronique à Lisbonne pendant 11 ans. En 2019, elle s'est installée à Londres pour terminer son doctorat et travailler dans les domaines de l'IA et de du Covid-19. Elle est actuellement spécialiste des workflows avancés chez Leica Microsystems et travaille au centre d'imagerie de l'EMBL à Heidelberg.