¿Qué es la Tomografía Crioelectrónica?
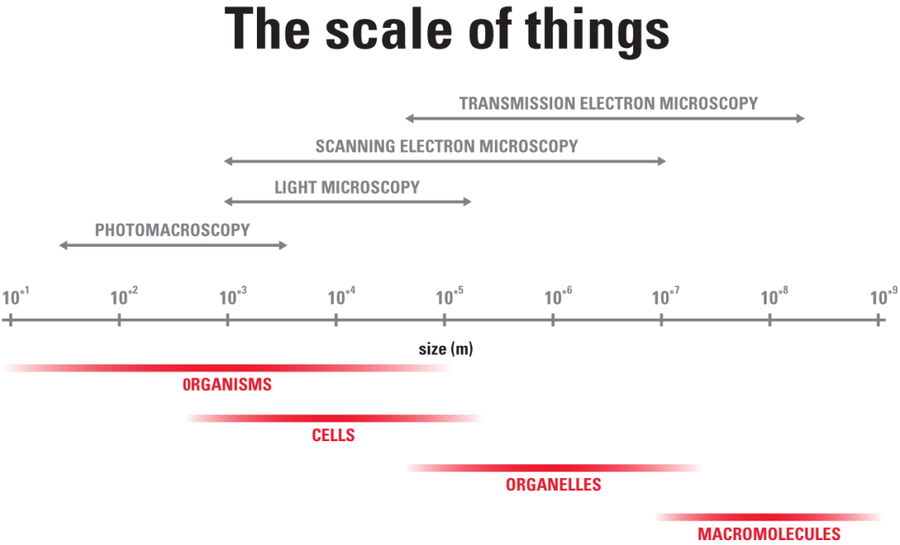
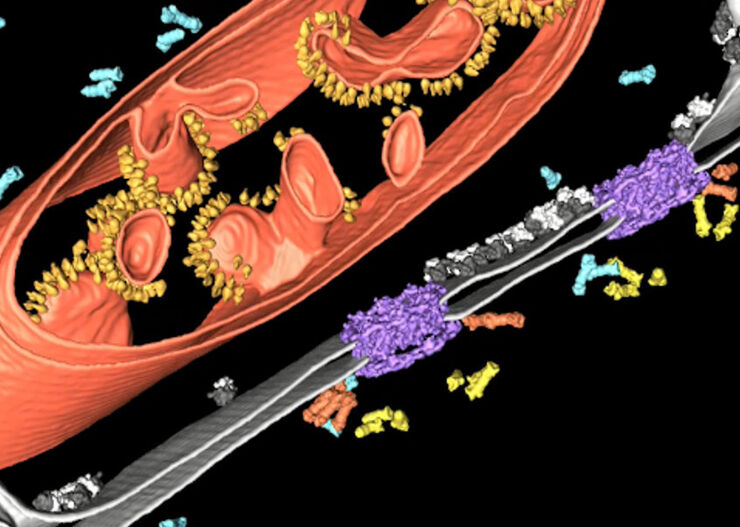
La tomografía crioelectrónica (también conocida como criotomografía electrónica) permite analizar con resolución molecular tridimensional las interacciones entre proteínas en su estado nativo y funcional. La muestra se representa en una serie de imágenes bidimensionales, ya que se inclina en una serie controlada de posiciones. A continuación, los «cortes» resultantes de la imagen se pueden combinar para producir una reconstrucción 3D de la muestra.
Artículos relacionados
The Cryo-CLEM Journey
New Imaging Tools for Cryo-Light Microscopy
Improve Cryo Electron Tomography Workflow
¿Cuáles son los pasos de un flujo de trabajo CryoET?
La técnica consiste en la preparación de muestras, que se colocan en rejillas de microscopía electrónica y luego se sumergen rápidamente en nitrógeno líquido para vitrificar la muestra y evitar la formación de cristales de hielo.
Para realizar una criotomografía de alta resolución, el grosor de corte de la muestra con imágenes no debe ser superior a 300 nm. Para observar las partes «más gruesas» de las muestras, como los cuerpos celulares, hay que diluir la muestra. Además de la crioultramicrotomía, el método de elección es el fresado con haz de iones enfocado (FIB) con un microscopio electrónico de crioescaneo específico o multimodal. Se colocan dos ventanas del haz de iones de tal manera que se crea una fina lámina de hielo (lamellas) de aproximadamente 200 nm de grosor en el área de interés para que sea accesible para Cryo ET.
Las muestras preparadas ahora se pueden escanear con el microscopio electrónico de transmisión criogénica y, a continuación, se debe llevar a cabo el proceso de reconstrucción de datos para reconstruir las imágenes 2D en un único modelo 3D.
¿Cuáles son los retos en un flujo de trabajo típico de CryoET?
El mayor reto asociado con un flujo de trabajo típico de CryoET está relacionado con la dificultad de identificar el área de interés precisa que contiene la célula o proteína de la que se va a obtener una imagen. Los fallos repetidos en la localización pueden dar lugar a múltiples repeticiones de un proceso que requiere mucho tiempo, lo que, en última instancia, desperdicia un costoso tiempo de obtención de imágenes por microscopio electrónico (EM). Otros dos retos en el flujo de trabajo incluyen garantizar que la calidad de la muestra y el grosor del hielo sean uniformes en todo momento, así como mantener las muestras adecuadamente vitrificadas antes de transferirlas al Cryo TEM.
¿Cómo se pueden superar los retos de CryoET con la criomicroscopía óptica?
La criomicroscopía óptica puede contribuir positivamente al flujo de trabajo de CryoET de dos formas importantes.
En primer lugar, la microscopía óptica ayuda a evaluar la calidad de la muestra. El criomicroscopio óptico ofrece una visión general rápida de la calidad de congelación y el grosor del hielo de la muestra, así como de si la distribución de la muestra es óptima para su posterior procesamiento. Las soluciones criogénicas de Leica garantizan que las muestras se mantienen seguras y viables durante estos pasos.
En segundo lugar, el mayor potencial del criomicroscopio óptico para una mayor eficiencia del flujo de trabajo es la capacidad de enfocar la estructura que le interesa con mucha más precisión antes de que comiencen las preparaciones de CryoEM, que requieren mucho tiempo y dinero. Las soluciones de criomicroscopía óptica de Leica permiten la exportación de imágenes y coordenadas de la estructura objetivo hacia los pasos posteriores de EM, lo que reduce en gran medida el tiempo de obtención de imágenes de EM.

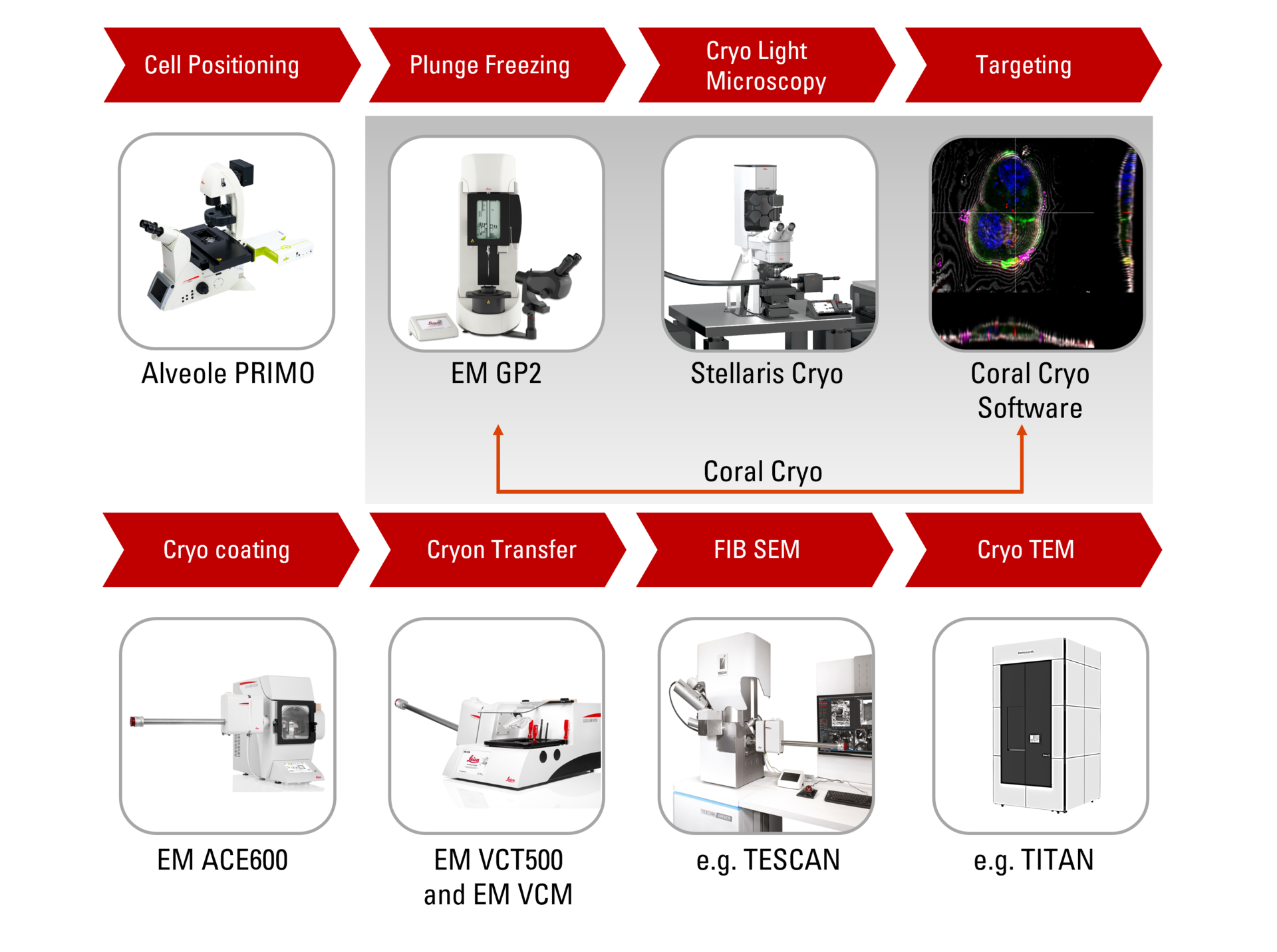
Presentamos Coral Cryo: el flujo de trabajo CryoET más eficaz hasta la fecha
Las soluciones especializadas de flujo de trabajo de tomografía crioelectrónica en 3D de Leica superan los retos típicos al garantizar la viabilidad de las muestras, los controles de calidad y, sobre todo, un mecanismo de localización en 3D preciso y fiable. Utilice nuestro hardware optimizado, que incluye la platina criogénica y la lanzadera, junto con el software de localización CryoET de última generación, así como una variedad de opciones perfectas de integración y transferencia a las platinas Cryo FIB o VCT.
Disfrute de la localización precisa de volúmenes en 3D
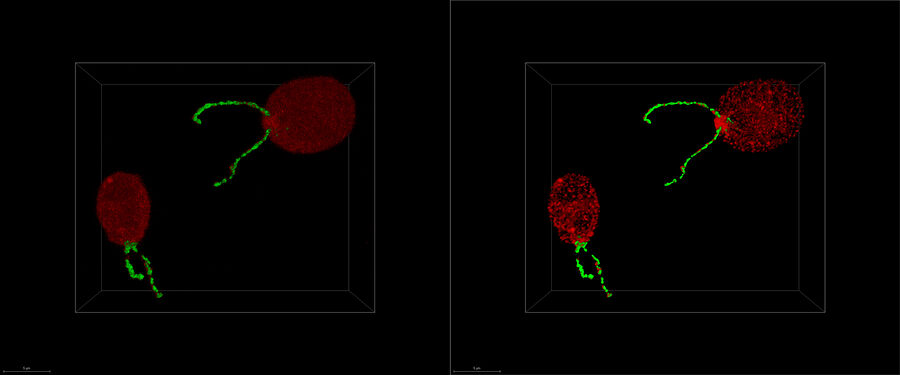
Descubrirá cómo el flujo de trabajo de la tomografía crioelectrónica perfecto Coral Cryo de Leica Microsystems utiliza la superresolución confocal para focalizar la estructura que le interesa de forma más precisa. El flujo de trabajo reduce y optimiza el número de pasos del flujo de trabajo, mejora la carga y la transferencia de muestras y, por lo tanto, mejora la productividad del flujo de trabajo de CryoET.
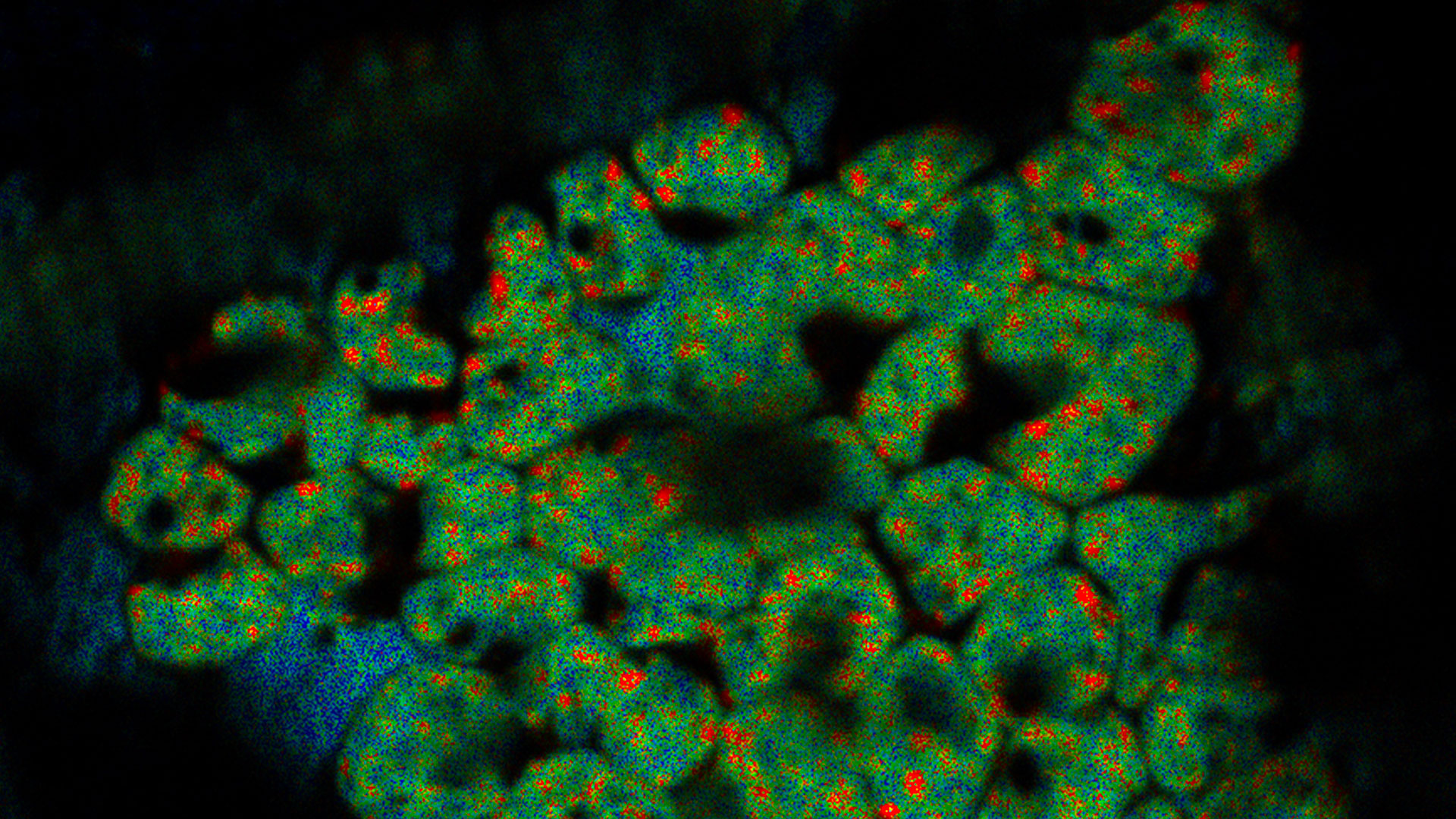
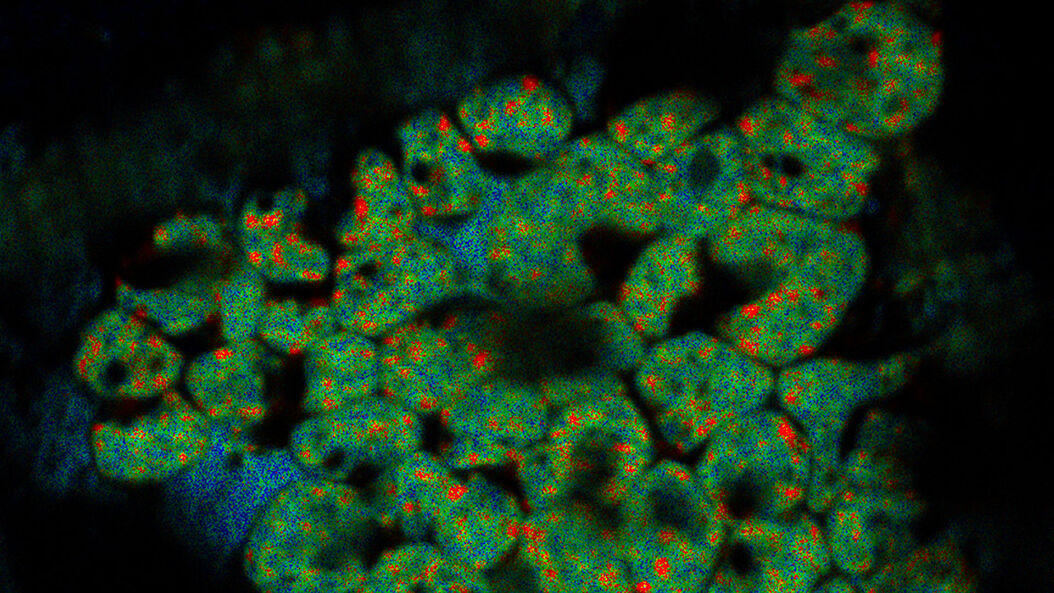
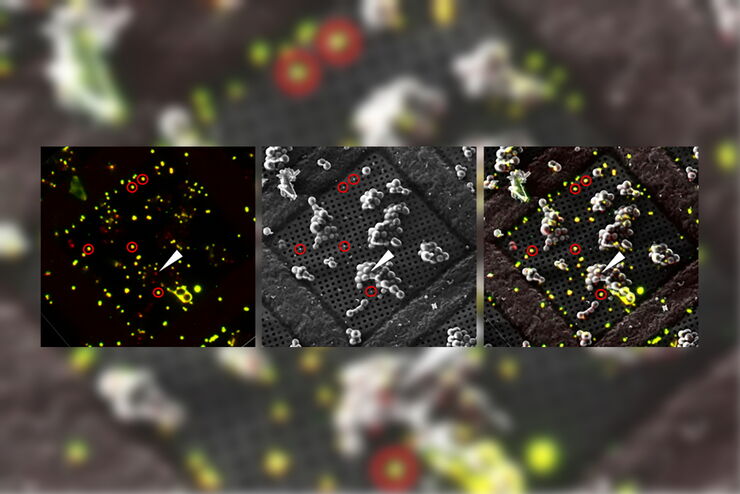
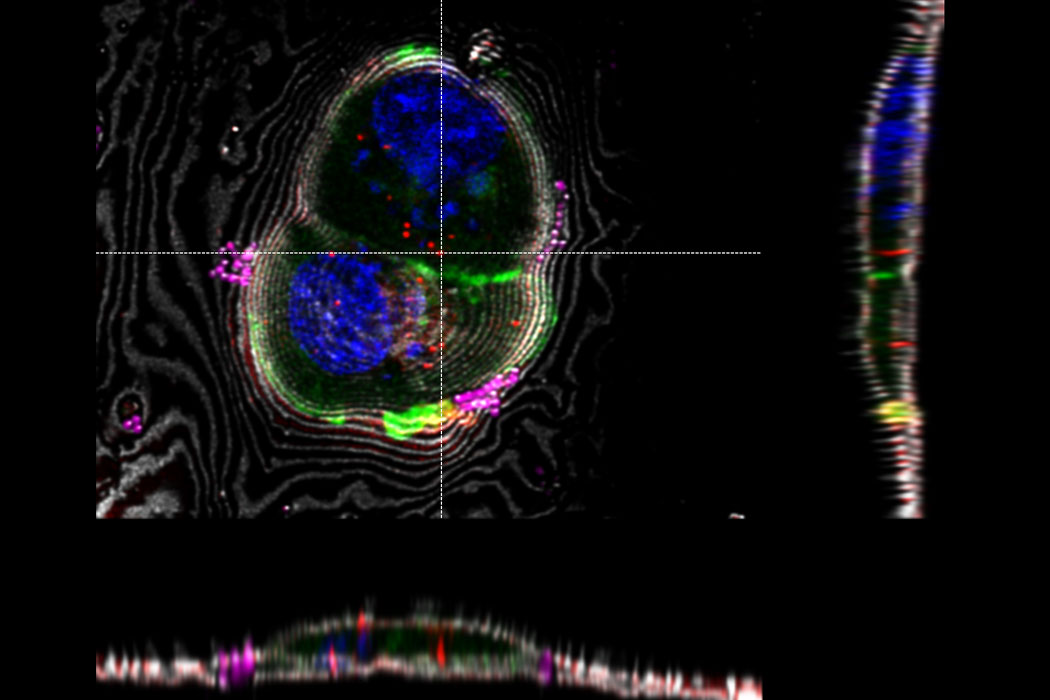
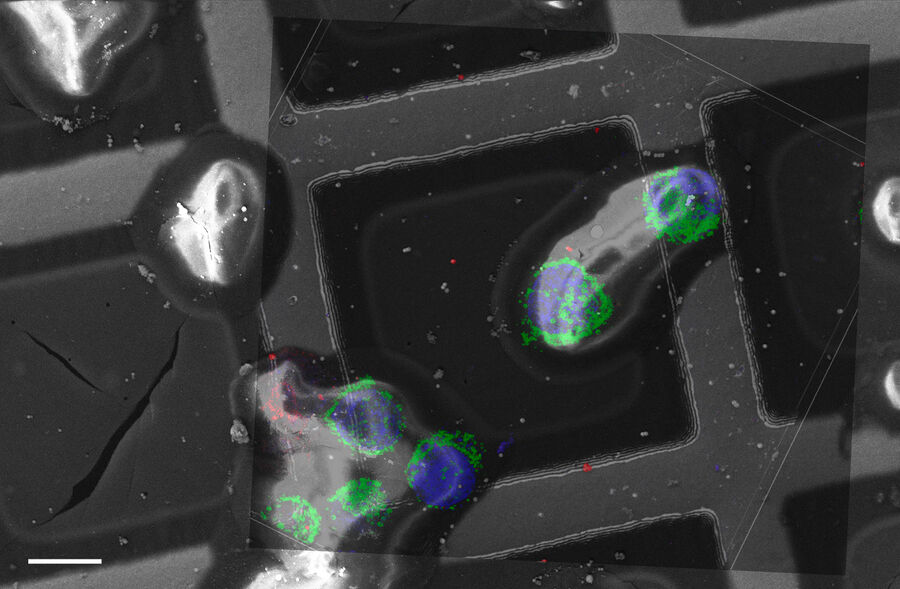
Superposición de una imagen 3D confocal con superresolución con la vista superior de SEM (panel izquierdo) y la vista de FIB (panel derecho). La superposición se realizó utilizando las microesferas como puntos de referencia para la correlación. Las células HeLa se marcan de la siguiente manera: núcleos de Hoechst, azul; mitocondrias de MitoTracker Green, verde; gotas lipídicas de Bodipy y Crimson Beads, rojo. Barra de escala: 20 µm. Células proporcionadas amablemente por Ievgeniia Zagoriy e imágenes SEM/FIB proporcionadas amablemente por Herman Fung, Mahamid-Group, EMBL-Heidelberg, Alemania.
Artículos relacionados
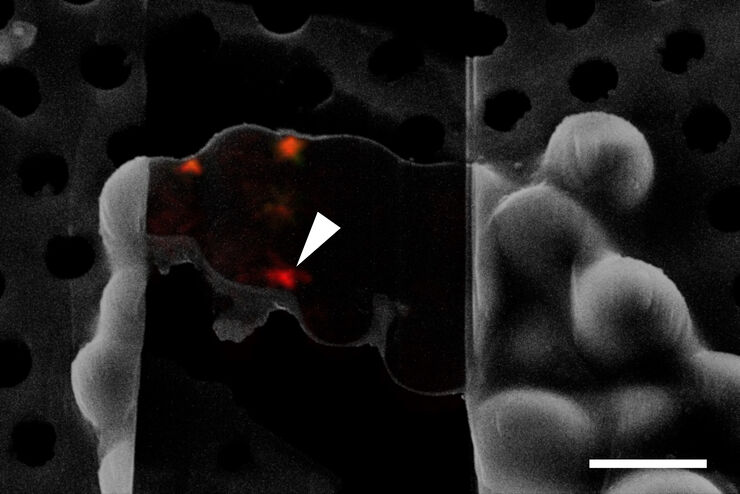
How to Target Fluorescent Structures in 3D for Cryo-FIB Milling
Targeting Active Recycling Nuclear Pore Complexes using Cryo Confocal Microscopy
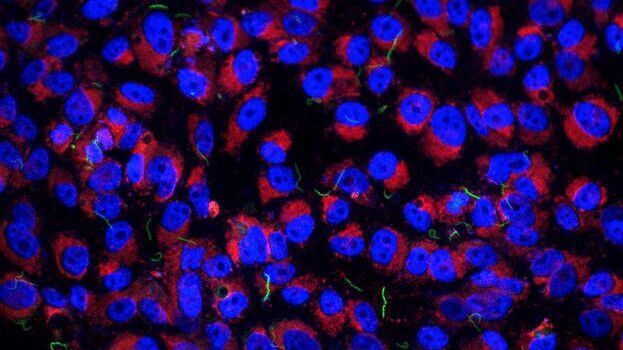
Advancing Cell Biology with Cryo-Correlative Microscopy
Workflows and Instrumentation for Cryo-electron Microscopy
Qué elegir: ¿Cryo Widefield o Cryo Confocal?
Características | Confocal | Thunder (Widefield) |
|---|---|---|
| Sensibilidad | * | |
| Velocidad | * | |
| Resolución lateral | ** | * |
| Resolución axial | ** | * |
| Optimización de la excitación y la emisión de colorantes para las condiciones de obtención de imágenes criogénicas | ** | * |
| Supresión de autofluorescencia (muestra o capa de carbono) | * | |
| Localización y exportación | 3D | 2D |