Aufnahmen von Zeitserien
Bei der Aufnahme von Zeitserien [1,2] werden Bilder einer Probe über einen bestimmten Zeitraum mit einer bestimmten Geschwindigkeit, in der Regel als Einzelbilder pro Sekunde (fps) bezeichnet, aufgenommen. Wenn die Bildaufnahmerate niedriger ist als die Betrachtungsrate, die zur Beobachtung der aufgenommenen Bilder verwendet wird und die Bildsequenz wie ein Video beobachtet wird, scheint die Zeit beschleunigt. Umgekehrt verhält es sich, wenn die Bildaufnahmerate höher als die Betrachtungsrate ist. Dann scheint die Zeit verlangsamt. Daher ermöglichen Aufnahmen von Zeitserien die Beobachtung langer mikroskalischer Ereignisse, die über Minuten, Stunden oder Tage auftreten, innerhalb von Sekunden, Minuten oder Stunden. Die Aufnahme von Zeitserien wird für die Untersuchung lebender Proben wie Zellkulturen, akuter Gewebeproben und Modellorganismen verwendet, die im Laufe der Zeit wachsen und sich entwickeln. Das Ziel ist, mehr Erkenntnisse über biologische Prozesse zu gewinnen [3,4]. Die Zellmigration ist zum Beispiel wichtig für multizelluläre Organismen während der embryonalen Entwicklung, der Gewebereparatur, der Funktion des Immunsystems und der Tumorinvasion. Um die Veränderungen von Zellen und Organismen über einen Zeitraum genau zu verfolgen, werden „Längsschnitt"Studien“ [5] verwendet, bei denen dieselbe Probe unter spezifischen Bedingungen über einen festgelegten Zeitraum beobachtet wird.
Sphäroide
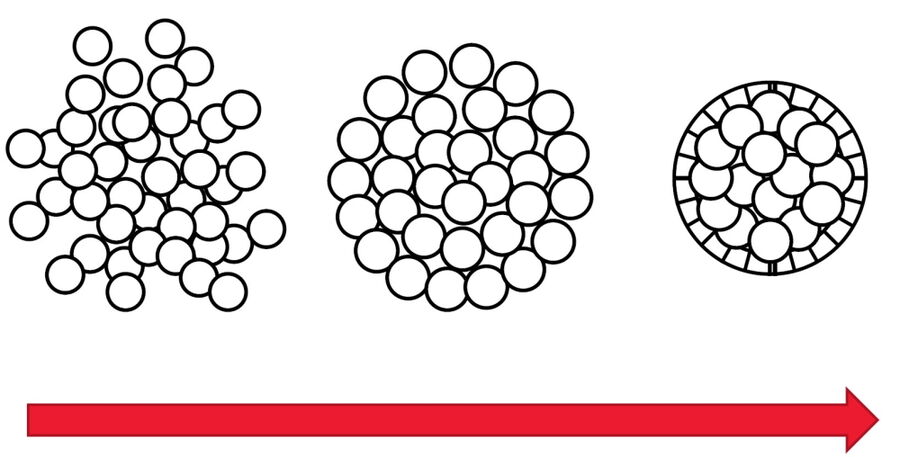
Sphäroide sind eine Art von dreidimensionalen Zellkulturen, wie Organoide, die die physiologischen Funktionen von lebenden Geweben und Organen imitieren [6]. Zweidimensionale Monolayer-Zellkulturen sind normalerweise Zellen, die einfach flach auf einem Substrat wachsen. Sphäroide und andere dreidimensionale Zellkulturen können zu großen Volumina heranwachsen, die dreidimensionale Zell-Zell-Interaktionen ermöglichen, was dem natürlichen Gewebe in einem Organismus nahe kommt. Diese dreidimensionalen Zellkulturen können für die Forschung verwendet werden, um ein besseres Verständnis von Zellen in einer lebensnahen Mikroumgebung zu erhalten. Sphäroide sind nützlich für Anwendungen in der Neurowissenschaft, regenerativen Medizin sowie Krebs- und Herz-Kreislauf-Forschung.
Die Herausforderungen
Bei Experimenten mit Aufnahmen langer Zeitserien von Sphäroiden können sich bestimmte Herausforderungen ergeben. Da die Experimente mehrere Tage oder sogar Wochen dauern können, muss die Probe möglichst lange am Leben erhalten werden. Das heißt, es müssen nahezu physiologische Bedingungen herrschen. Die Expression von Fluoreszenzmarkern muss auf endogenen Niveaus gehalten werden, um eine Beeinträchtigung der Zellhomöostase zu verhindern. Es muss eine stabile Nährstoffversorgung und eine unveränderte Konzentration im Medium gegeben sein, die durch Verdunstung beeinträchtigt werden kann. Eine korrekte Bildgebung über lange Zeiträume erfordert, dass die mikroskopische Bildaufnahme im Fokus bleibt und an sich ändernde Probenmerkmale, wie laterales und axiales Wachstum, angepasst wird.
Forschungslabore verfügen möglicherweise nicht über die Instrumente, die für eine Aufnahme von Zeitserien dreidimensionaler Zellkulturen erforderlich sind. In diesem Fall müssen Forscher in der Regel Zugang zu gemeinsamen Einrichtungen haben, die von mehreren Anwendern genutzt werden, um dieses Problem zu umgehen. Doch es kann unter Umständen lange dauern, bevor die benötigten Instrumente verfügbar sind. Dieser Umstand verzögert möglicherweise die Gewinnung wichtiger, quantifizierbarer Ergebnisse, die aber wichtige Grundlage für den Gewinn neuer Erkenntnisse und entscheidender Durchbrüche sein kann.
Wir stellen vor: Mica
Mica, der weltweit erste Mikrohub für die Bildgebung, vereint alles, was Forscher benötigen, in einer vollständig kontrollierten, hochflexiblen Umgebung, die Mikroskopie-Workflows beschleunigt, um aussagekräftige wissenschaftliche Ergebnisse zu erhalten. Diese Vorteile bietet Mica seinen Anwendern:
- Zugang für alle Einfache Einrichtung kontrollierter Umgebungsbedingungen, Anpassung der Fokusstrategie und Einrichtung der Bildgebungsbedingungen
- Deutlich vereinfachte Arbeitsabläufe. Anmerkungen auf dem Bildschirm und Extraktion mehrerer Parameter
- Uneingeschränkte Möglichkeiten. Optimale Umgebungsbedingungen und verschiedene Bildgebungsverfahren (Hellfeld, Weitfeld und Konfokal), um den Versuchsanforderungen gerecht zu werden, sowie intelligente Automatisierung für Wasserimmersion und Fokusstrategien.
Methoden
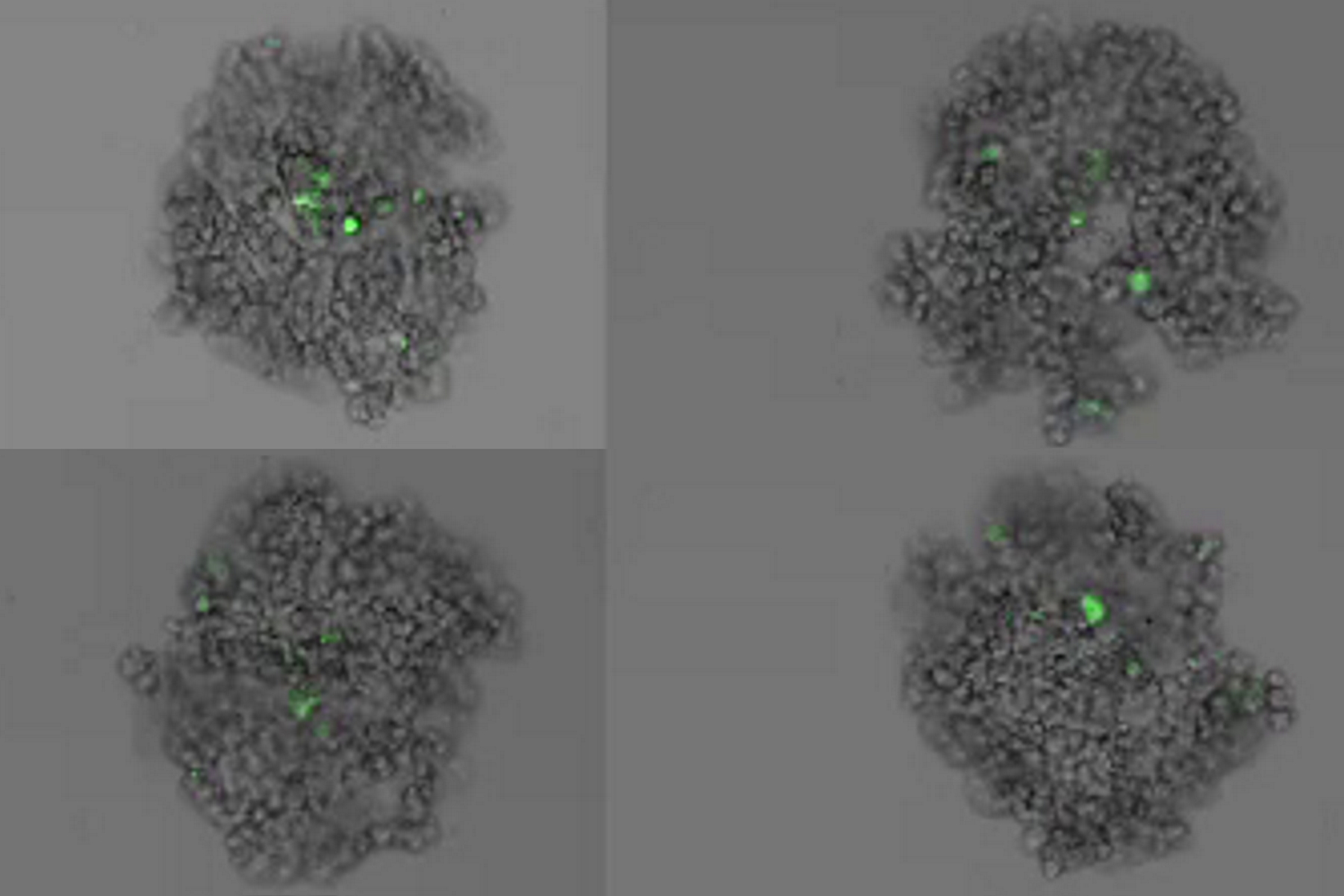
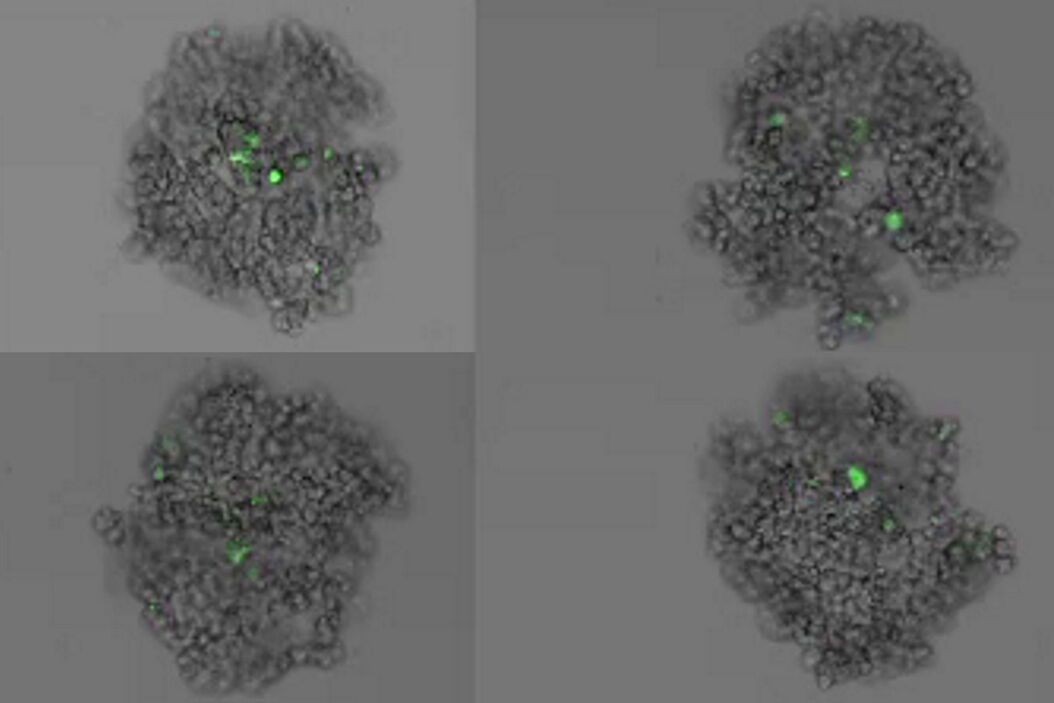
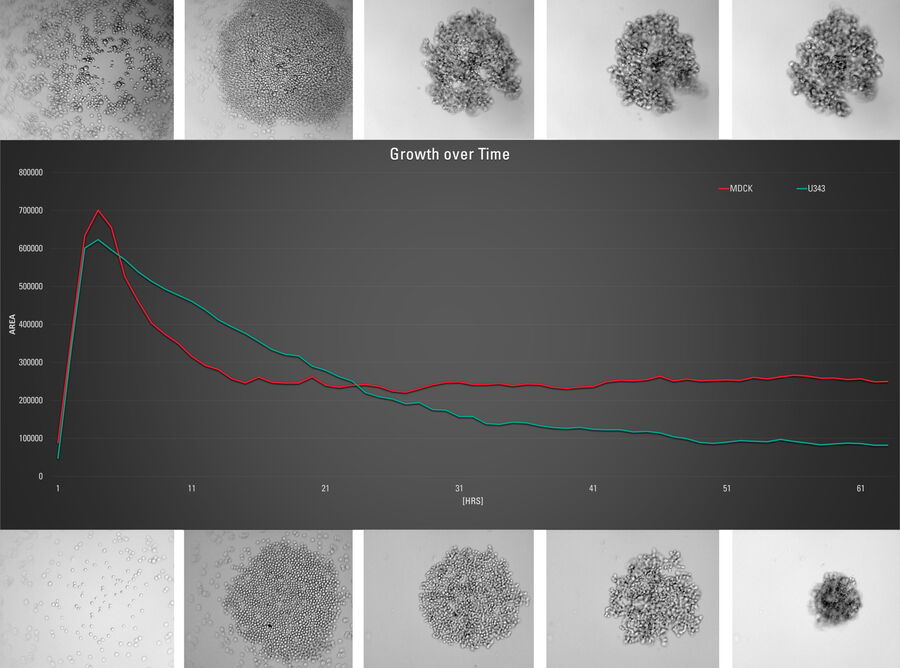
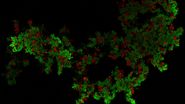
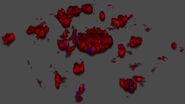
Bei dieser Langzeit-Time-Lapse-Studie wird Mica eingesetzt, um die Bildung von Sphäroiden zu untersuchen, die entweder von U343-Zellen oder MDCK-Zellen ausgehen, die stabil mit MX1-GFP transfiziert wurden. Das Wachstum von Sphäroiden erfordert optimale physiologische Bedingungen, die ungestörte Zellzyklen und Proliferation gewährleisten [6,7]. Frühere Ergebnisse zeigen, dass das Wachstum selbst oft mit der Expression spezifischer Proteine oder Marker für bestimmte Merkmale von Zellstadien und Differenzierung korreliert [6,7].
Mica wird für diese Schlüsselanwendung als Inkubator verwendet, um dreidimensionale Zellkulturen und Sphäroide unter nahezu physiologischen Bedingungen und minimierter Medienverdunstung zu erhalten. Mit Mica können Anwender das Wachstum von Sphäroiden messen und die Proteinexpression analysieren.
Bilder und Daten, die während der Zeitserien-Studie über einen längeren Zeitraum zur Bildung von dreidimensionalen Sphäroiden und deren Wachstum erfasst wurden, sind in den Abbildungen 2 und 3 dargestellt.