Opto-digitale Bildverarbeitungstools wie Computational Clearing [2] können helfen, das Signal-Hintergrund-Verhältnis zu verbessern und die Unschärfe zu reduzieren. Die damit verbundene Kontrastverstärkung kann zusätzliche Informationen in Mikroskopbildern sichtbar machen.
Immunfluoreszenz viraler Proteine
Außer durch Einsatz von Sequenzierungstechniken, Bioinformatik und Elektronenmikroskopie haben Ogando et al. [1] infizierte Zellen mittels Fluoreszenzmikroskopie analysiert: Vero E6-Zellen wurden auf Deckgläsern gezüchtet, mit SARS-CoV-2 infiziert und mit Paraformaldehyd fixiert. Dann wurden die Zellen mit Antiseren von Kaninchen oder Mäusen inkubiert, die zuvor mit SARS-CoV infiziert worden waren (Abbildung 2). Die von SARS-CoV stammenden Antikörper, die an SARS-CoV-2-Strukturen in Vero E6-Zellen binden, wurden dann mit fluoreszenzmarkierten Sekundärantikörpern nachgewiesen. Zusätzlich wurden die Zellkerne mit Hoechst gefärbt. Die Fluoreszenzbildgebung wurde mit dem aufrechten DM6 B Fluoreszenzmikroskop durchgeführt.
Kreuzreaktion der SARS-CoV-Antiseren mit SARS-CoV-2
Die Immunfluoreszenzmikroskopie zeigte die Kreuzreaktivität vieler SARS-CoV-Antiseren in mit SARS-CoV-2 infizierten Zellen (virale Proteine nsp3, nsp4, nsp5, nsp8, nsp9, nsp13, nsp15, N, M). Dieser Umstand bedeutete, dass gegen SARS-CoV hergestellte Antiseren auch in SARS-CoV-2-infizierten Zellen zu einer charakteristischen Fluoreszenzfärbung führen (Abbildung 3). Während die nsps-Proteine in der perinukleären Region der infizierten Zellen gefunden wurden, war das N-Protein im gesamten Zytosol verteilt. Das M-Protein wurde im Golgi-Apparat nachgewiesen.
Potenzial der aufrechten Fluoreszenzmikroskopie für die Virologie-Forschung
Die in der Studie von Ogando et al. [1] beschriebenen kreuzreagierenden Antiseren sind ein nützliches Instrument zur Charakterisierung des Replikationszyklus von SARS-CoV-2. Dies ermöglicht es Forschern, potenzielle Ziele für Replikationshemmer festzulegen.
Ein relativ einfacher Versuchsaufbau – die Immunfluoreszenzmikroskopie – reicht aus, um Rückschlüsse auf den viralen Replikationszyklus zu ziehen. Da die Zellen für diese Methode auf Deckgläschen gezüchtet und auf Glasobjektträger montiert werden, bietet sich ein aufrechtes Fluoreszenzmikroskop an. Automatisierte Versionen mit einem motorisierten Tisch in Kombination mit einem großen Sichtfeld (FOV) helfen dem Benutzer, schnell große Übersichten zu erhalten. Wenn einzelne Aufnahmen ausreichen, ist ein manuell bedienbarer mechanischer Tisch die sinnvollere Wahl.
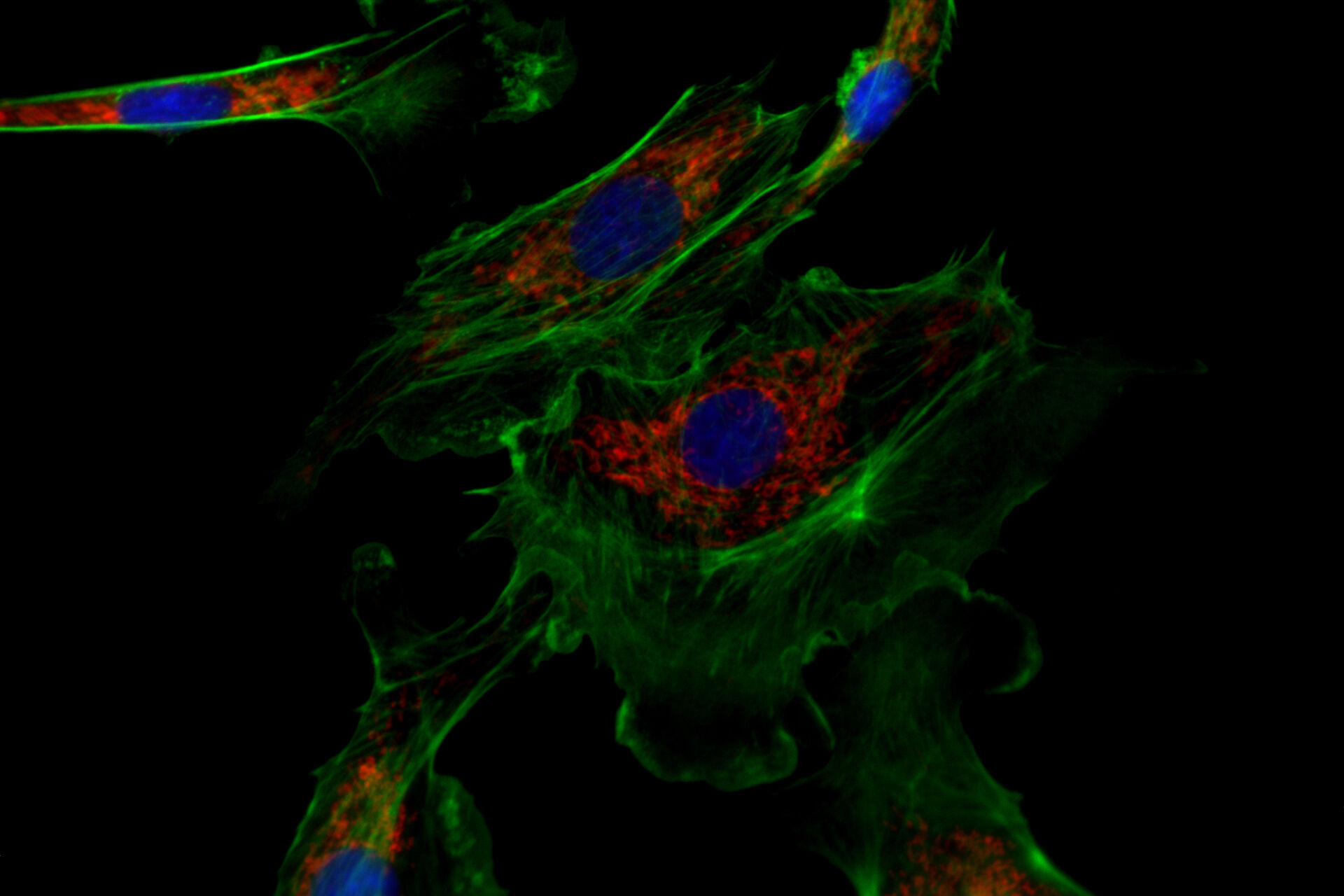
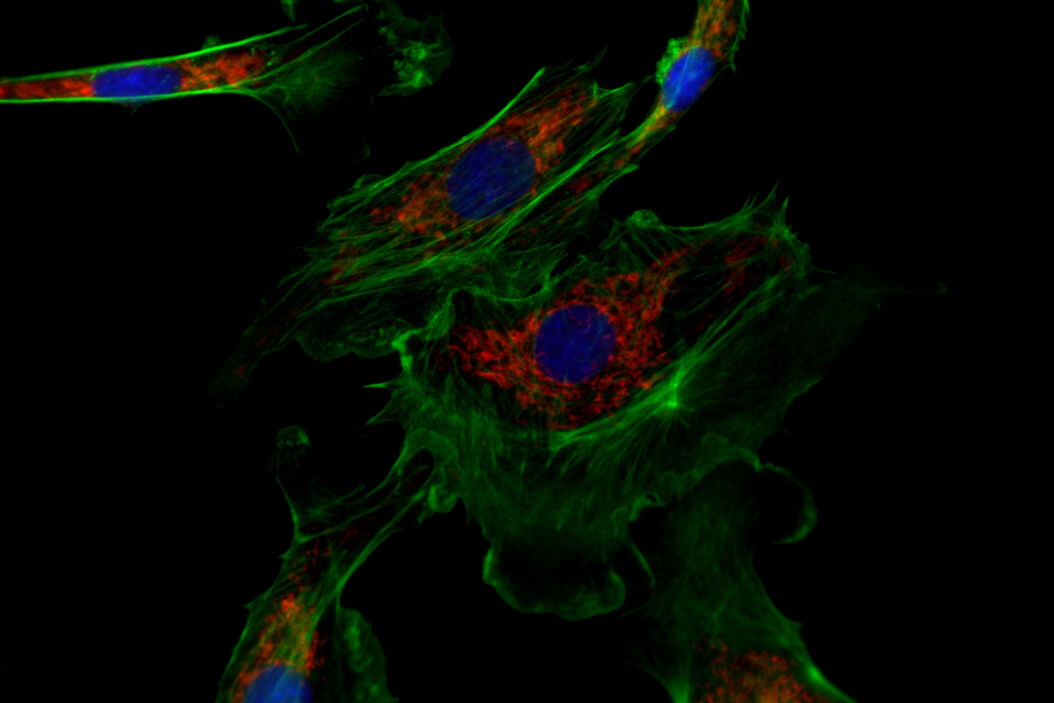
![Eines der Experimente von Ogando et al. [1] umfasste den Einsatz der Immunfluoreszenzmikroskopie zur Bildgebung von Vero-E6-Zellen. Abb. 2: Eines der Experimente von Ogando et al. [1] umfasste den Einsatz der Immunfluoreszenzmikroskopie zur Bildgebung von Vero-E6-Zellen. Im Prinzip untersuchten sie das Potenzial von Antiseren, die während des Ausbruchs in den Jahren 2002 und 2003 bei Kaninchen oder Mäusen gegen SARS-CoV produziert wurden. Sie benutzten verschiedene Kaninchen-Antiseren als ersten Satz von Antikörpern. Dann wurden diese Kaninchenantiseren mit einem zweiten Satz fluoreszierender Antikörper markiert. Anschließend wurden mit dem Fluoreszenzmikroskop DM6 B Aufnahmen gemacht.](/fileadmin/_processed_/f/c/csm_Vero_E6_cells_imaged_with_immunofluorescence_microscopy_Ogando_Serum_1bf2c697b4.png)
![Immunfluoreszenzmikroskopie von mit SARS-CoV-2 infizierten Vero E6-Zellen, die mit Kaninchen-SARS-CoV-Antiseren behandelt wurden. Abb. 3: Immunfluoreszenzmikroskopie von mit SARS-CoV-2 infizierten Vero E6-Zellen, die mit Kaninchen-SARS-CoV-Antiseren behandelt wurden [1]. Nsps-Proteine befinden sich in der Nähe des Zellkerns, während das M-Protein im Golgi-Apparat zu finden ist. Anti-dsRNA-Antikörper wurden verwendet, um replikative Zwischenstufen der viralen RNA-Synthese zu markieren. Die Zellkerne wurden mit Hoechst gefärbt. Der Maßstab beträgt 25 μm für 3a und 3b und 100 μm für 3c, 3d und 3e.](/fileadmin/_processed_/a/4/csm_Cross-reactivity_of_antisera_SARS-CoV_proteins_c7b9ba4f6c.jpg)