Material und Methoden für die Planktonanalyse
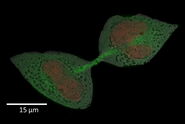
Dinoflagellaten wurden gesammelt, indem ein Netz (5 oder 10 µm Maschenweite) 10 Minuten lang mit langsamer Geschwindigkeit durch das Oberflächenwasser der Bucht von Villefranche-sur-Mer (Frankreich) geschleppt wurde. Nach der Entnahme an Bord wurden die Proben dann durch serielle Siebe (Retsch) gefiltert, um Zellen mit einer Größe von weniger als 40 µm zu sammeln. Im Labor wurde diese Fraktionsgröße (1) durch Filtration auf einer 1.2 gemischten Zelluloseestermembran (Merck) mit manuellem Pumpen konzentriert; (2) in einem endgültigen Volumen von etwa 4 ml resuspendiert und (3) für 5 Minuten bei 1000 g zentrifugiert. Der Überstand wurde entfernt und ca. 1,2 µl des Pellets wurden in einen mit Hexadecen (Merck) vorbeschichteten Gold-Kupfer-Typ-A-Träger (Leica; 200 µm tief und 3 mm breit) geladen. Die Probe wurde mit der flachen Seite eines Aluminiumträgers vom Typ B (Leica) bedeckt, der ebenfalls mit Hexadecen (Merck) vorbeschichtet war, und mit dem Leica EM ICE unter Hochdruck eingefroren.
Die kryofixierten Proben wurden einer Gefriersubstitution (EM AFS2, Leica) unter Verwendung des folgenden Programms und der folgenden Lösungen unterzogen: 60 Stunden bei -90 °C in 2 % Osmiumtetroxid in Aceton, Heizrate von 2 °C/h für 15 Stunden bis -60 °C, 10 Stunden bei -60 °C, Heizrate von 2 °C/h für 15 Stunden bis -30 °C, 10 h bei -30 °C, maximale Heizrate auf 0 °C in 1 Minute, 1 Stunde bei 0 °C, maximale Kühlrate auf -30 °C in 1 Minute, 5 Waschgänge bei -30 °C mit reinem Aceton.
Die Zellen wurden dann nach und nach mit EPON hard infiltriert. Die verwendeten Harzserien (ohne Beschleuniger)/Aceton (v/v) waren 25 % für 2 Stunden, beginnend bei -30°C bis -10°C, 50 % für 2 Stunden, beginnend bei -10°C bis +10°C mit einer Heizrate von 5°C/h und 75 % für 2 Stunden, beginnend bei +10°C bis +20°C mit einer Heizrate von 10°C/h. Die Proben wurden dann nacheinander für 12 und 48 Stunden in 100% Harz ohne Beschleuniger infiltriert.
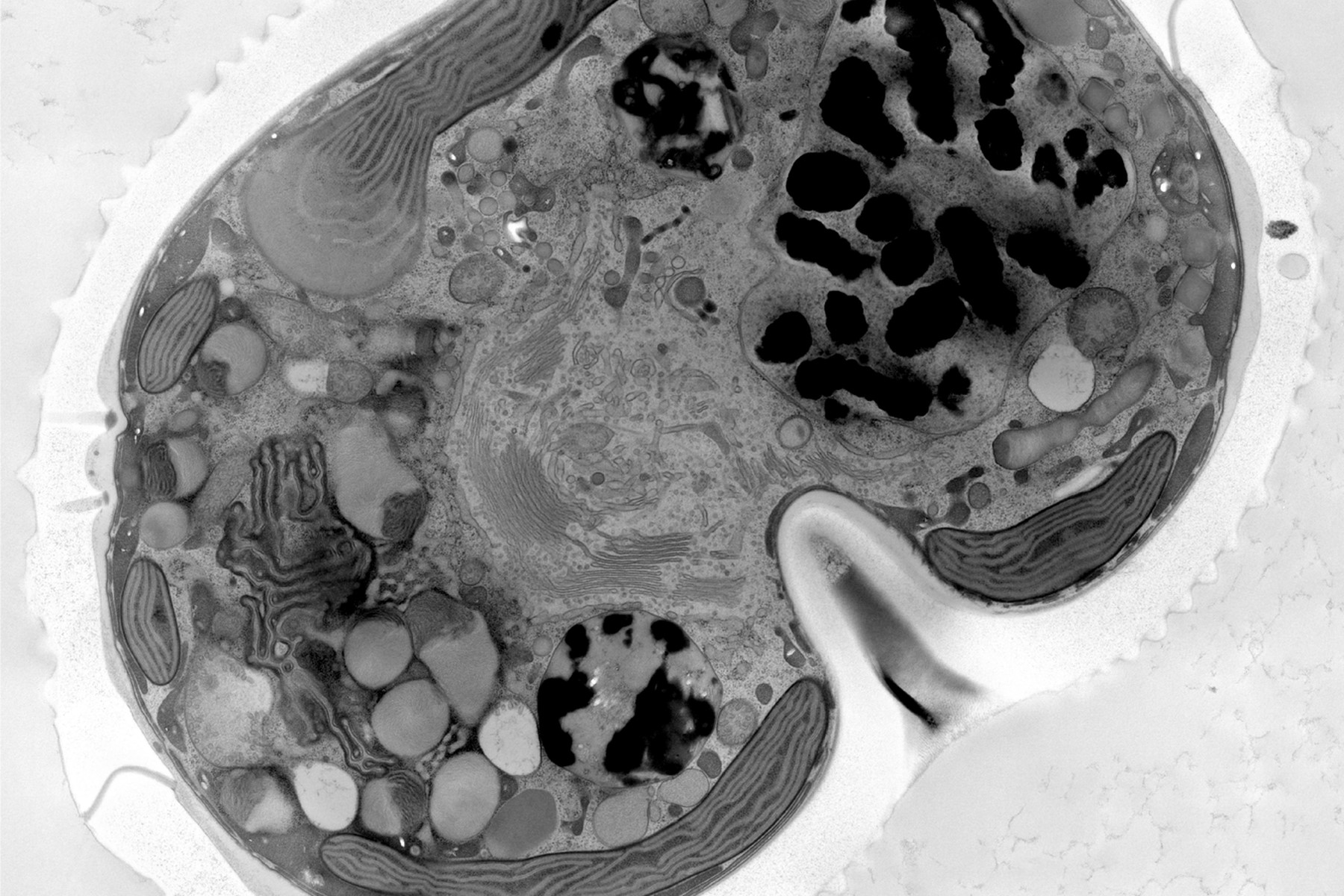
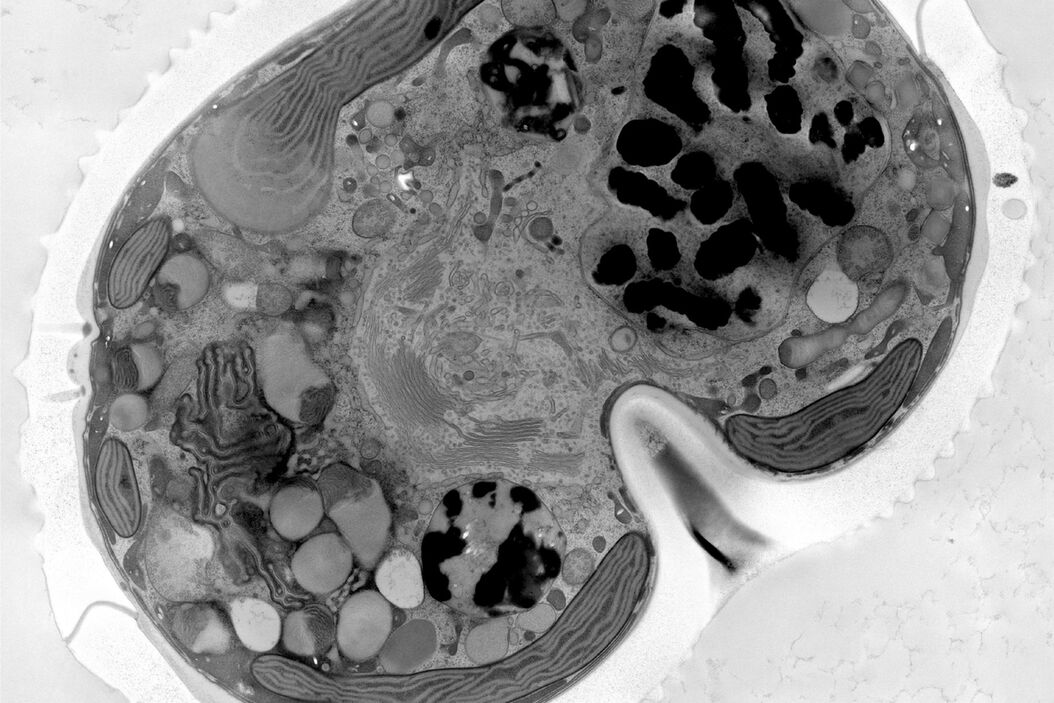
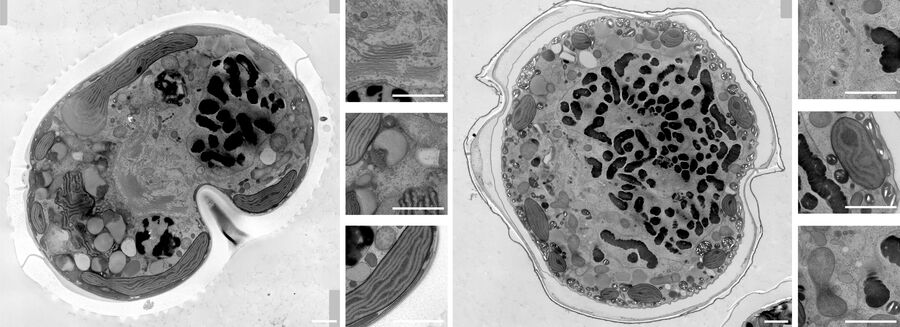
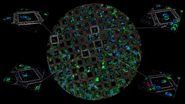
Die Infiltration mit 100 % Harz, das Beschleuniger enthält, wurde dann zwei Mal für 3 Stunden und einmal über Nacht durchgeführt, bevor die Polymerisation bei 60°C für 48 Stunden erfolgte. Mit einem Ultramikrotom (Leica EM UC7) und einem Ultradiamantmesser (Diatome) wurden 70 nm dünne Schnitte erstellt. Diese Dünnschnitte wurden dann nacheinander mit 1 % Uranylacetat in Wasser für 20 Minuten und Bleizitrat für 3 Minuten nachgefärbt. Die Kachelmontagen wurden mit SerialEM auf dem JEOL JEM 2100plus bei 120Kv und 8000facher Vergrößerung aufgenommen. Die Montagen wurden mit Imod und Fiji bearbeitet. Die unter hohem Druck eingefrorenen Proben wurden in der Electron Core Microscopy Facility (EMCF) am EMBL Heidelberg bearbeitet.