Leica und das EMBL Imaging Centre – Freien Zugang möglich machen
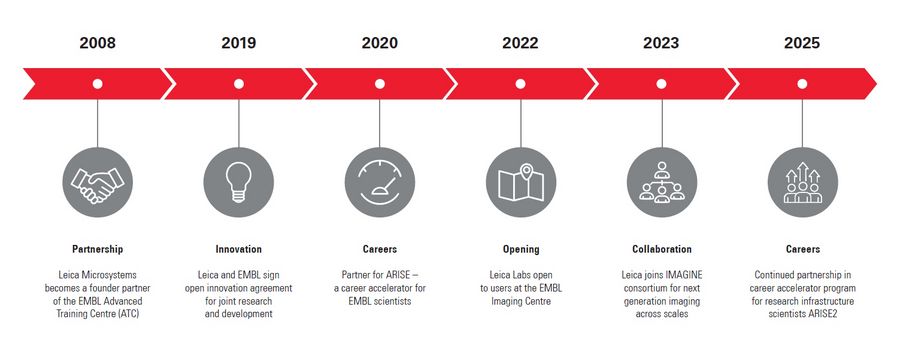
Im Laufe seiner Geschichte hat Leica mit Begeisterung Beziehungen zu akademischen und wissenschaftlichen Forschungseinrichtungen aufgebaut, um das wissenschaftliche Verständnis durch Mikroskopie zu fördern. Dank unserer besonderen Partnerschaft mit dem European Molecular Biology Laboratory (EMBL) in Heidelberg haben Forscher jetzt Zugang zu modernster Probenvorbereitungs- und Bildgebungstechnologie.
Leica unterstützt das EMBL in seinem Bestreben, die molekularen Grundlagen des Lebens besser zu verstehen, durch die Bereitstellung neuester Technologien und fachkundiger Unterstützung für eine breite Palette wissenschaftlicher und experimenteller Dienstleistungen. Damit hilft Leica den Wissenschaftlern, die Grenzen ihrer Forschung zu erweitern und neue Erkenntnisse zu gewinnen.
Leica ist einer von vier Industriepartnern, die dazu beigetragen haben, die Vision des EMBL Imaging Centre zu verwirklichen, das 2022 offiziell eröffnet wurde.
Erfahren Sie auf der Website des EMBL IC, welche Instrumente zur Verfügung stehen.
Interviews
Interview mit Yassin Harim, Doktorand am Deutschen Krebsforschungszentrum, Heidelberg
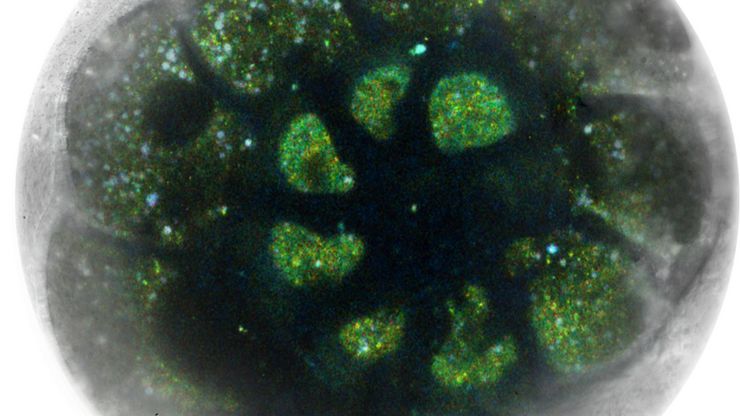
Gewinnen Sie Einblicke in die 3D-Gesamtdarstellung von Mäusegehirnen mit Hilfe der Mehrfarben-Immunfluoreszenz! Nach Aussage unseres Gastanwenders aus dem Deutschen Krebsforschungszentrum war die Verwendung von THUNDER Imager Live Cell am EMBL IC "... die perfekte Lösung, um Bilder in sehr hoher Qualität zu erhalten und gleichzeitig wenig Zeit für die Bildaufnahme aufzuwenden, weil die Erfassung jedes einzelnen Objektträgers einfach so schnell geht".
Interview with Virginia Pierini – Service Manager EMBL IC, Heidelberg. Virginia Pierini unterstützt den Betrieb des EMBL Imaging Centers in Bezug auf alle seine Dienstleistungen, mit besonderem Augenmerk auf die Anwender. Sie ist die Ansprechpartnerin des Imaging Centers für alle Anwender und bietet Hilfe bei den Zugangsverfahren, der Projektdurchführung und der Anwenderschulung.
Interview mit Virginia Pierini, Service Manager EMBL IC, Heidelberg
Virginia Pierini unterstützt den Betrieb des EMBL Imaging Centers in Bezug auf alle seine Dienstleistungen, mit besonderem Augenmerk auf die Anwender. Sie ist die Ansprechpartnerin des IC für alle Anwender und bietet Hilfe bei den Zugangsverfahren, der Projektdurchführung und der Anwenderschulung.
Interview mit Giorgia Susin, Doktorandin, Universität Trient, Italien
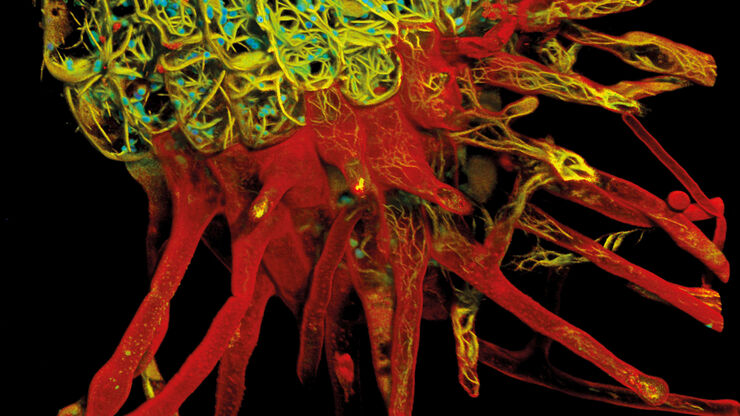
Giorgia Susin untersucht den Transport nicht-kodierender RNA in Xenopus laevis-Neuronen mithilfe des STELLARIS-Mikroskops, um Wechselwirkungen zwischen RNA und Organellen aufzudecken und das Verständnis des RNA-Transports zu verbessern. Durch Live-Aufnahmen in der Super-Resolution-Bildgebung mit TauSTED XTend konnte sie durch minimale Lichtexposition die Probe schützen und erzielte gleichzeitig hochauflösende Einblicke.
Das EMBL Imaging Centre beherbergt modernste Instrumente von Leica und anderen Herstellern sowie solche, die in EMBL-Forschungsgruppen entwickelt wurden.
Das EMBL IC bietet Forschern Zugang zu wissenschaftlichen Experten sowohl aus dem akademischen Bereich als auch aus der Industrie und bietet Anwendern die Möglichkeit, Spitzenforschung mit einer Reihe von Tools und Unterstützung zu betreiben, die den meisten Wissenschaftlern nicht zur Verfügung stehen.
Die Experten von Leica Microsystems sind ständig am EMBL IC vor Ort, um Forschern die Nutzung von Daten der fortschrittlichen Bildgebungssysteme zu ermöglichen, um damit bahnbrechende Erkenntnisse zu gewinnen.
Produktspezifikationen
Hier finden Sie detaillierte Produktinformationen zu den im EMBL Imaging Centre ausgestellten Konfigurationen
STELLARIS 8 STED Falcon und STELLARIS STED
- Fünf spektral abstimmbare Power-HyD-Detektoren zur Photonenzählung (2 HyD S, 2 HyD X, 1 HyD R)
- Konfokalmikroskopie: abstimmbare Weißlichtlaser (WLL) 440-790 nm, 405 nm STED-Depletion: 592 nm, 660 nm, 775 nm
- 8kHz Resonanz-Scanner
- Totale Systemtotzeit: 1,5 ns
- TauSTED: Abstimmbare Auflösung auf der Grundlage der Lebensdauer (je nach Probe und Fluorophor): < 30 nm (lateral) und < 100 nm (axial). Automatischer lebenszeitbasierter Algorithmus zur Unterdrückung des Hintergrunds. Reduzierung der Lichtdosis (WLL-Anregung) für alle STED-Linien (592, 660, 775 nm). Erhältlich für 2D- und 3D-STED in lebenden und fixierten Proben, auch für mehrfarbige Anwendungen. Automatisierter, in die LAS X-Software integrierter Arbeitsablauf.
- Die STED WHITE Glycerin- und Wasserobjektive mit motCORR-Technologie bieten eine adaptive optische Korrektur von Aberrationen, die durch Inhomogenitäten der Proben und Fehlanpassungen des Brechungsindex verursacht werden. Die STED WHITE Objektive bieten einen Arbeitsabstand von 300 µm:
- HC PL APO 86x/1,20 W motCORR STED WHITE
- HC PL APO 93x/1.30 GLYC motCORR STED WHITE
- HC PL APO 100x/1.40 OIL STED WHITE"
STELLARIS 8 DIVE Falcon
- Laserlinien IR: regelbar 680–1080 nm und 680–1300 nm, fest 1040 nm; Konfokal: Weißlichtlaser (WLL) 440 –790 nm, 405 nm und 488 nm
- Vier NDD-Kanäle, ausgestattet mit Power HyD X (regelbar von 380–800 nm), fünf spektral regelbare Detektoren mit interne Zählung (3 HyD S, 1 HyD X und 1 HyD R)
- Aufrechtes konfokales Stativ mit festem Tisch (DM6 CFS), ausgestattet mit Scientifica-Scanningtisch
STELLARIS Cryo
- STELLARIS Scankopf mit 5 HyD-Detektoren (2 HyD S, 2 HyD X, 1 HyD R)
- Laserversorgungseinheit mit Superkontinuum-Laser (440–790 nm) und einer Diodenlaserlinie mit 405 nm.
- sCMOS-Kamera K5
- Aufrechtes Konfokalmikroskop DM6 mit festem Tisch
- HC PL APO 50x/0,90 CRYO CLEM Kryo-Objektiv
- Motorisierter Objektivrevolver mit 6 Positionen für Arbeiten bei Raumtemperatur mit verschiedenen Objektiven 10x–100x
- Märzhäuser-Tisch ausgestattet mit Kryo-Tisch oder Probenhalter für RT-Imaging und mehreren Verfahrbereichen für Kryo- und Raumtemperatur.
25 l Dewar mit Kryopumpe und Kryosteuergerät
STELLARIS Cryo ist Teil von Coral Cryo CLEM Arbeitsablauf, der zusätzlich besteht aus EM GP2 EM VCM plus EM VCT500 Kryo-Transfer-Shuttle oder EM ACE600 Beschichtungsanlage plus EM VCT 500 Kryo-Transfer-Shuttle.
MICA Microhub
- Integrierter Modulationskontrast (IMC) und Hellfeld-Durchlichtbildgebung im RGB- oder Graustufenmodus
- AUFLICHT-FLUORESZENZ-BELEUCHTUNG LED 365 nm, 470 nm, 555 nm, 625 nm
- 4 simultane Weitfeld-Detektionskanäle mit FluoSync Spektral-Unmixing
- KONFOKALBELEUCHTUNG Laserdiode 405 nm, 488 nm, 561 nm, 638 nm
- 4 simultane konfokale Detektionskanäle (HyD FS) mit FluoSync Spektral-Unmixing
- Inkubationssystem Temperatur (Raumtemperatur +3 °C bis 45 °C), CO2 (0–10 %), Luftfeuchtigkeit
- Wasserspender mit geschlossenem Kreislauf für die Immersion von Objektiven. Die Wasserimmersion für ein Objektiv ist rückkopplungsgesteuert und erfordert keine Interaktion des Anwenders.
- THUNDER-Methoden: Instant Computational Clearing (ICC), Small Volume Computational Clearing (SVCC), Large Volume Computational Clearing (LVCC)
- LIGHTNING Methoden Basic, LIGHTNING Expert
THUNDER Imager Live Cell
- Basierend auf dem vollmotorisierten, inversen High-End-Forschungsmikroskop DMi8
- High-Speed-Positionierung mit dem Quantum-Tisch und dem Synapse real-time Controller
- High-Speed-Beleuchtung mit einer multi-line LED-Lichtquelle
- Schnell schaltbares externes Filterrad
- Adaptive Focus Control (AFC) mit Closed Loop Focus
Klimakammer gewährleistet optimale physiologische Bedingungen für lebende Zellen
THUNDER Imager Live Cell ist Teil des Coral Life CLEM-Workflows für Lebendzellen, der aus dem THUNDER Imager Live Cell, der EM ICE-Hochdruckgefrieranlage und dem EM AFS2 für die automatische Gefriersubstitution besteht.
THUNDER Imager 3D Tissue
- Basiert auf einem vollautomatischen aufrechten Forschungsmikroskop für die Aufnahme von mehrfarbigen 3D-Bildern.
- sCMOS-Kamerasystem
- Software erstellt unschärfefreie, große Übersichten der gesamten Gewebeprobe
- Präziser motorisierter Z-Fokus-Antrieb zur Aufnahme von Bildern in Z-Richtung und deren Visualisierung mit dem 3D-Viewer
EM GP2
- Arbeitstemperatur einstellbar zwischen +4 °C und +60 °C
Relative Luftfeuchtigkeit bis 99 % einstellbar
Das EM GP2 ist Teil des Coral Cryo CLEM-Workflows, bestehend aus EM GP2, STELLARIS 5 Cryo und EM VCM plus EM VCT500 Cryo Transfer Shuttle oder EM ACE600 Coater plus EM VCT 500 Cryo Transfer Shuttle.
EM ICE
- Modul für Elektro- und Lichtstimulation
Automatische Entleerung des LN2-Dewars
Das EM ICE ist Teil des Coral Life CLEM-Workflows für Lebendzellen, der aus dem THUNDER Imager Live Cell, der EM ICE-Hochdruckgefrieranlage und dem EM AFS2 für die automatische Gefriersubstitution besteht.
EM ACE600
- Automatisierter, rezepturbasierter Sputterbeschichtungsprozess
- Hochwertige Kohlenstoffschichten durch Kohlenfadenbeschichtung, Kohlenstabbeschichtung oder Elektronenstrahlverdampfung
Präzise, robuste und amorphe Schichten mit einer Dicke im Sub-Nanometerbereich
Der ACE600 ist Teil des Coral Cryo CLEM-Workflows, bestehend aus EM GP2, STELLARIS 5 Cryo und EM VCM plus EM VCT500 Cryo Transfer Shuttle oder EM ACE600 Coater plus EM VCT 500 Cryo Transfer Shuttle.
EM AFS2
EM FSP (Freeze Substitution Processor), sein automatisches System für die Handhabung von Reagenzien.
Der EM AFS2 ist Teil des Coral Life CLEM-Workflows für Lebendzellen, der zusätzlich aus dem THUNDER Imager Live Cell und der EM ICE-Hochdruckgefrieranlage besteht.
Bringen Sie Ihr Forschungsprojekt zum EMBL und lassen Sie sich von den Anwendungsspezialisten von Leica Microsystems unterstützen.

Robert Kirmse
Robert Kirmse hat am DKFZ und an der Universität Heidelberg promoviert. Als Postdoktorand arbeitete er an der Tumorzellinvasion bei BioQuant, Heidelberg, und in der Kryo-EM an der University of Colorado, Boulder, USA. Seit 2019 ist er bei Leica Microsystems als Senior Manager für Probenvorbereitung und Standortleiter in Wien tätig. Seit Oktober 2022 leitet er das Leica EMBL IC-Team für wissenschaftliche Innovation.
Robert Kirmse
Robert Kirmse hat am DKFZ und an der Universität Heidelberg promoviert. Als Postdoktorand arbeitete er an der Tumorzellinvasion bei BioQuant, Heidelberg, und in der Kryo-EM an der University of Colorado, Boulder, USA. Seit 2019 ist er bei Leica Microsystems als Senior Manager für Probenvorbereitung und Standortleiter in Wien tätig. Seit Oktober 2022 leitet er das Leica EMBL IC-Team für wissenschaftliche Innovation.

Andreia Pinto
Andreia Pinto arbeitete 11 Jahre lang als Spezialistin für Elektronenmikroskopie in Lissabon. Im Jahr 2019 zog sie nach London, um ihre Promotion abzuschließen und in den Bereichen KI und Covid-19 zu arbeiten. Derzeit ist sie Advanced Workflow Spezialistin bei Leica Microsystems und arbeitet am EMBL Imaging Centre in Heidelberg.