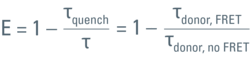Gründe für den Einsatz von FLIM-FRET
Intensitätsbasierte FRET-Methoden (weitere Informationen zu den Grundlagen von FRET finden Sie in den folgenden Abschnitten), die nur funktionieren, wenn fluoreszierende Donor- und Akzeptormoleküle verfügbar sind, verhalten sich recht anfällig gegenüber Schwankungen der Fluorophor-Konzentration. Ein Vorteil von FLIM-FRET ist, dass nur die Fluoreszenzlebensdauer des Donors gemessen werden muss. In Anwesenheit eines Akzeptors, wenn FRET auftritt, wird die Lebensdauer des Donors kürzer. Da die Lebensdauer unabhängig von der Fluorophor-Konzentration ist, ermöglicht die FLIM-FRET-Methode genaue Messungen trotz Konzentrationsschwankungen.
FRET - das Prinzip
Der Förster-Resonanz-Energietransfer (FRET) beschreibt die nicht-radiative Übertragung von Energie eines angeregten Fluorophor (dem Donor) auf ein nicht-angeregtes anderes fluoreszierendes Molekül (den Akzeptor) in seiner Nähe. Für ein FRET-Experiment werden potenziell bindende Makromoleküle wie Proteine und Nukleinsäuren mit spektral unterschiedlichen Fluorophoren so markiert, dass das Emissionsspektrum des Donor-Moleküls mit dem Anregungsspektrum des Akzeptor-Moleküls überlappt. Drei Bedingungen müssen erfüllt sein, damit FRET stattfinden kann:
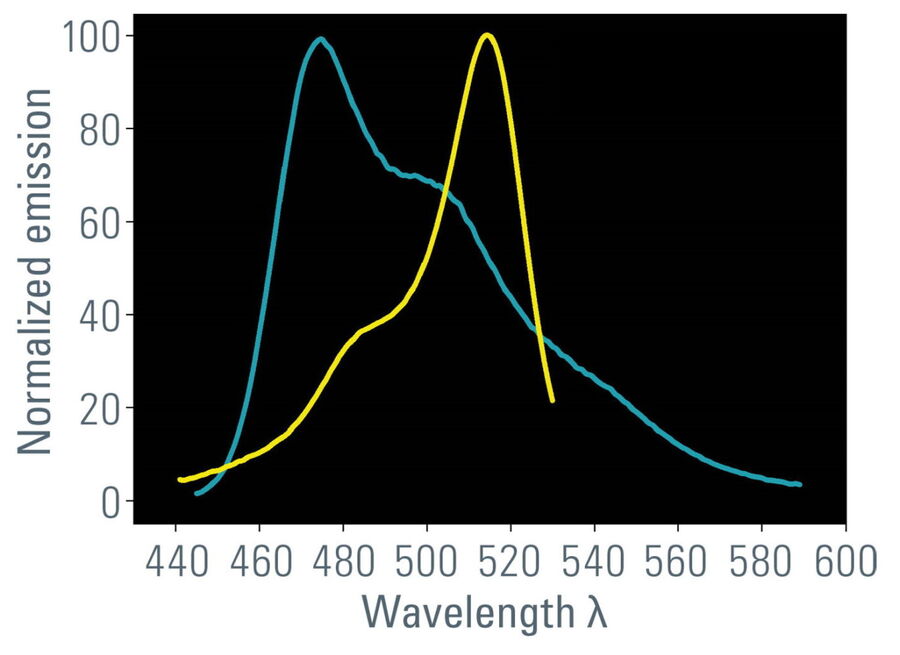
- Überlappen des Donor-Emissionsspektrums mit dem Akzeptor-Anregungsspektrum (Abbildung 1);
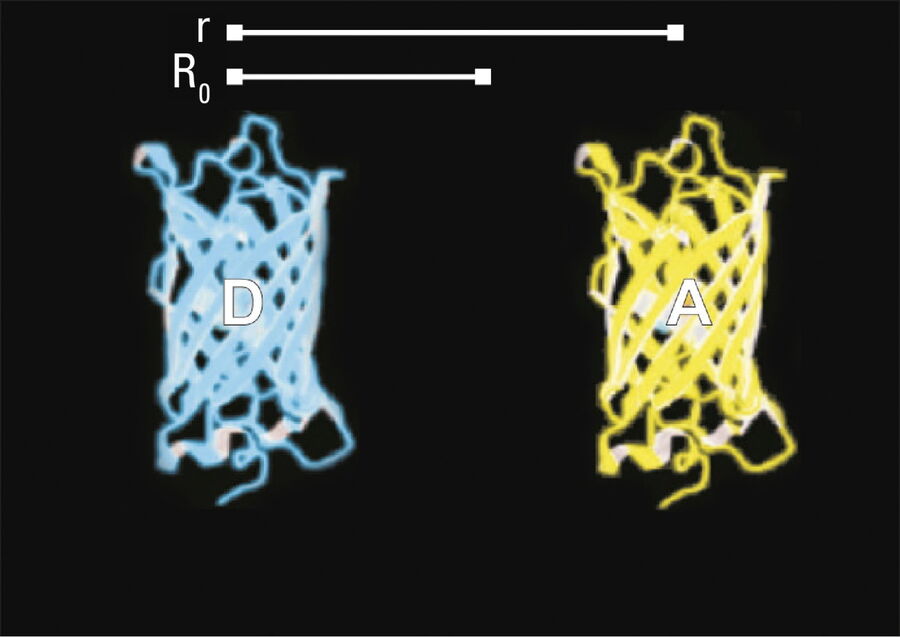
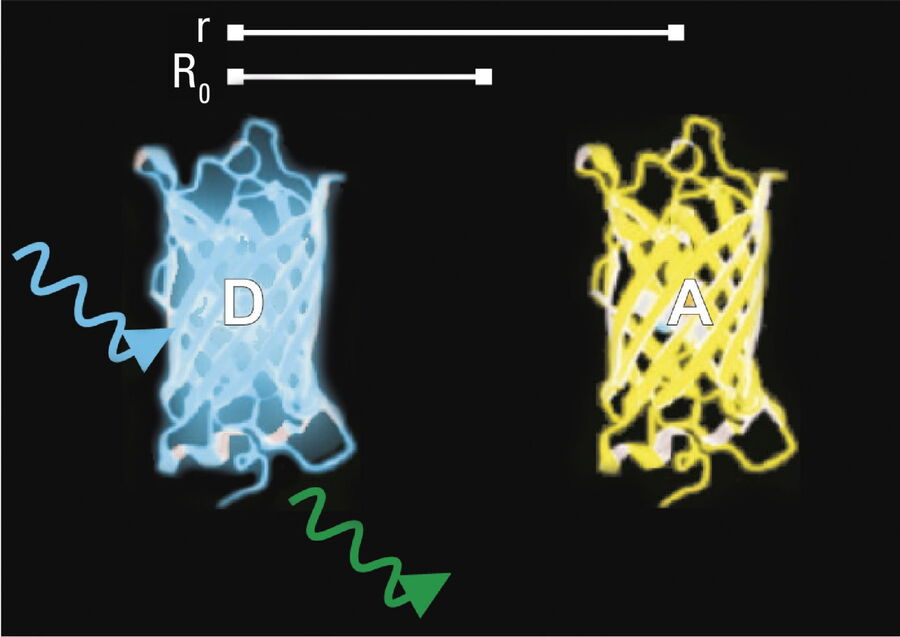
- Donor- und Akzeptormoleküle müssen sich in unmittelbarer Nähe befinden, d. h. weniger als 10 Nanometer (10-8 m) (Abbildungen 2-4); und
- Die Moleküle müssen die richtige relative Orientierung haben.
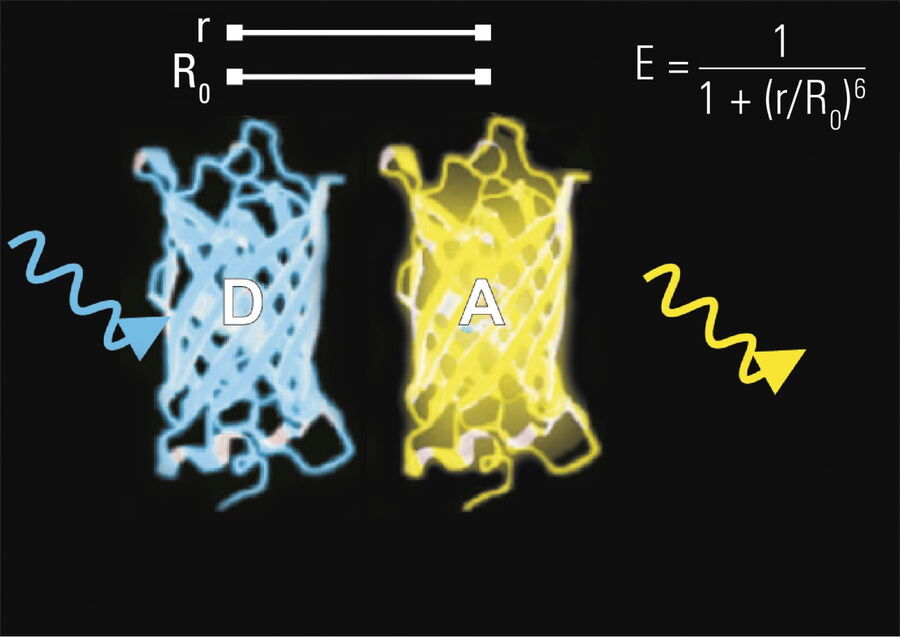
Die Effizienz (E) des FRET-Prozesses hängt stark vom Abstand zwischen Akzeptor und Donor, r, ab, wobei E = 1/[1+ (r/R0)6] und R0 der Försterradius ist (siehe Abbildung 4). Wenn die drei oben genannten Bedingungen erfüllt sind, kann der angeregte Donor seine Energie auf den Akzeptor übertragen. Der Akzeptor sendet seinerseits ein Photon aus, und die Fluoreszenzlebensdauer des Donor-Moleküls nimmt ab.
Die Wirkung
Aufgrund seiner starken Abhängigkeit vom Abstand zwischen Donor- und Akzeptormolekül (r-6, Abbildung 4) findet FRET auf einer räumlichen Ebene statt, die für biochemische Reaktionen, wie Protein-Protein- oder Protein-DNA-Wechselwirkungen, von großer Bedeutung ist. FRET kann molekulare Interaktionen durch eine sensitive Fluoreszenzanzeige untersuchen. Dies ermöglicht es Forschern, molekulare Interaktionen sowohl in vitro als auch in vivo zu untersuchen. Durch die Verknüpfung zweier interessanter Interaktionspartner mit geeigneten Fluoreszenzmarkern ist es möglich, bi-molekulare Interaktionen zu analysieren. Alternativ erlaubt FRET den Aufbau von biologischen Sonden, die Konzentrationen von zweiten Boten oder die Ionenstärke durch einen intra-molekularen FRET aufgrund einer starken Veränderung im Aufbau der Struktur anzeigen.
Es ist keine große Überraschung, dass sich FRET zu einem Instrument entwickelt hat, das in der Zellbiologie, Biophysik und biomedizinischen Bildgebung weit verbreitet ist.
Das Verfahren
Es gibt verschiedene Techniken in der Mikroskopie zum Nachweis von FRET. Allgemein bekannt sind Techniken, die auf der Fluoreszenzintensität entweder des Donors (Akzeptor-Photobleiche, FRET AB) oder des Akzeptors (sensibilisierte Emission, FRET SE) basieren.
Intensitätsbasierter FRET lässt sich leicht mit konfokalen Standardmikroskopen anwenden. Sie hat jedoch auch einige Nachteile. FRET AB kann nicht in Langzeitexperimenten eingesetzt werden und ist anfällig für reversible Photobleichung oder Photokonversion der Donor-Moleküle. FRET SE andererseits leidet unter dem spektralen Übersprechen, das bei allen FRET-Paaren auftritt, und erfordert sorgfältige Kalibrierungsmessungen sowie eine lineares Unmixing der resultierenden Bilder. Im Folgenden wird ein anderer Ansatz zur Messung von FRET beschrieben, der auf der Fluoreszenz-Lebensdauer-Imaging-Mikroskopie (FLIM) basiert.
Fluoreszenzlebensdauer
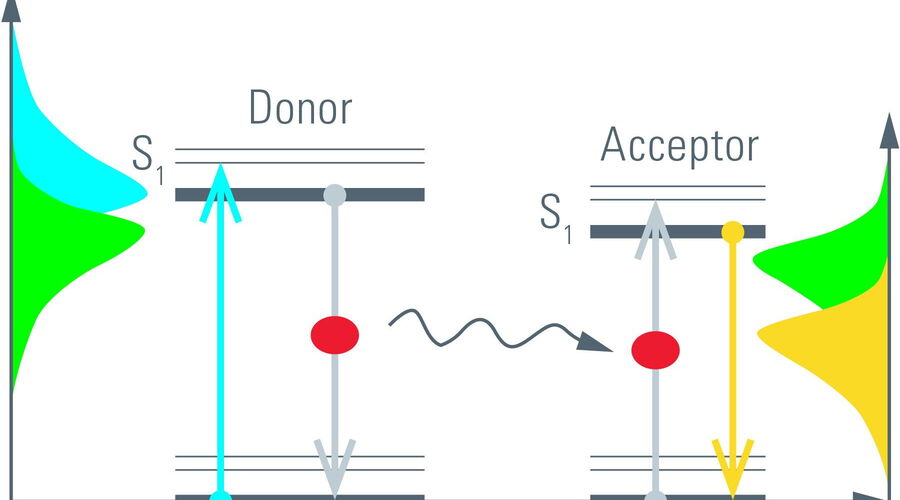
Oft wird der Prozess der Fluoreszenz als Energieübergang vom elektronischen Grundzustand (S0) zum angeregten Zustand (S1) in einem Molekül verstanden (Abbildung 5, links). Solche Übergänge können durch einfallendes Licht mit der entsprechenden Energie, d. h. Wellenlänge, hervorgerufen werden. Die absorbierte Energie wird von dem fluoreszierenden Molekül für eine kurze Zeit gespeichert, bevor sie als Fluoreszenz emittiert werden kann. Die Zeit, die ein Molekül in seinem angeregten Zustand bleibt, wird als Fluoreszenzlebensdauer bezeichnet [1]. Bei vielen organischen Farbstoffen und fluoreszierenden Proteinen (FP) liegt sie in der Regel in der Größenordnung von Nanosekunden (10-9 s).
Fluoreszenzlebensdauer und FRET
Ein alternatives Verfahren, um aus dem angeregten Zustand zu kommen, ist zum Beispiel FRET. Bei FRET wird die Anregungsenergie strahlungsfrei auf ein Akzeptormolekül übertragen. Der Akzeptor wiederum kann durch Fluoreszenz relaxieren (Abbildung 5, rechts). Da Donor-Fluoreszenz und Energietransfer konkurrierende Prozesse sind, erhöht sich die Geschwindigkeit in der der angeregte Zustand abgebaut, wenn FRET vorhanden ist. Je länger sich die Donormoleküle im angeregten Zustand befinden, desto wahrscheinlicher ist es, dass FRET stattfindet. Dabei werden nur die Photonen der Donor-Moleküle beobachtet, die durch Fluoreszenz relaxieren. Die auf Akzeptor-Moleküle übertragene Energie wird aufgrund der längeren Wellenlänge der Akzeptor-Fluoreszenz nicht erkannt. Daher verkürzt FRET die Lebensdauer des Donors (Abbildung 6).
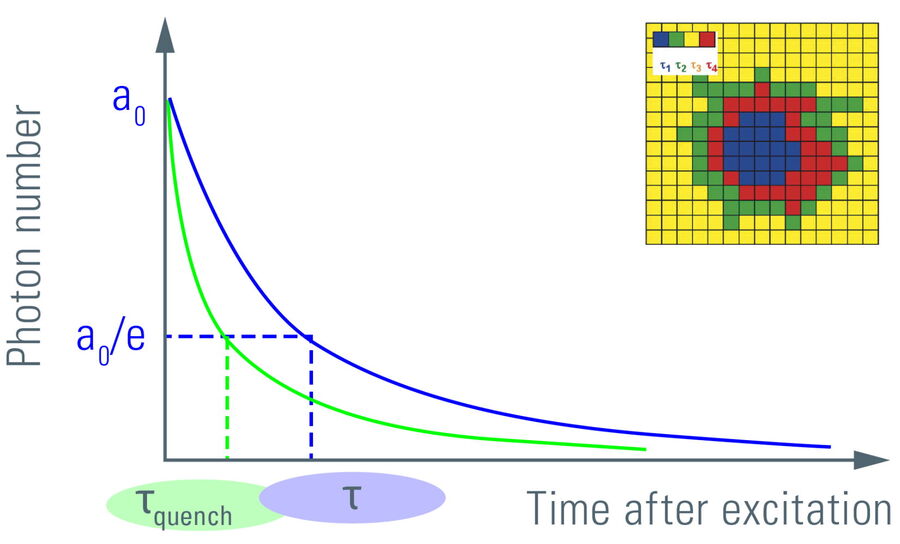
Abbildung 6: Verlauf der Photonenzahl der Fluoreszenz nach der Anregung über die verstrichene Zeit. Die anfängliche Anzahl der emittierten Photonen nach dem Anregungspuls, a0, fällt exponentiell ab. Die Fluoreszenz benötigt Zeit, um auf a0/e (~37%) abzuklingen, was der Fluoreszenzlebensdauer entspricht. Die Lebensdauer τ verschiebt sich aufgrund von FRET zu kürzeren Zeiten (τquench). Ein weiterer Indikator für den Abbau der Lebensdauer ist die Amplitude a0. Die Messung der Lebensdauer an jeder Position in einem Scan-System ergibt eine räumliche Karte der Lebensdauer (siehe Inset).
Fluoreszenzlebensdauer-Bildgebung (FLIM)
Fluoreszenzlebensdauer kann im Zeitbereich mit gepulsten Lasern und Einzelphotonenzählern gemessen werden [1,2]. Bei diesem Ansatz wird die Lebensdauer durch Erstellen eines Histogramms der erfassten Fluoreszenzereignisse bestimmt. Dies zeigt einen ein- oder multiexponentiellen Abbau der Fluoreszenz. Durch numerische Kurvenanpassung werden die Fluoreszenzlebensdauer und die Amplitude, d. h. die Anzahl der detektierten Photonen, ermittelt.
FLIM-FRET
Da FRET die Lebensdauer des Donors verringert, kann man das Ausmaß des FRET quantifizieren, sofern die Lebensdauer des Donors ohne FRET bekannt ist. Diese Donor-Lebensdauer, τ, dient als absolute Referenz, anhand welcher die FRET-Probe analysiert wird. Daher ist FRET-FLIM selbstkalibrierend – eine Eigenschaft, die viele der Unzulänglichkeiten intensitätsbasierter FRET-Messungen ausgleicht. Da die Fluoreszenz-Lebensdauer eine inhärente Eigenschaft jedes Farbstoffs ist, ist sie weitgehend unabhängig von anderen nachteiligen Effekten wie Photobleiche, Schattierung des Bildes, unterschiedlichen Konzentrationen oder Expressionsstufen. Die größte Einschränkung bei der intensitätsbasierten FRET-Messung ist die zugrundeliegende Annahme, dass alle beobachtbaren Donor-Moleküle FRET durchlaufen, was jedoch in der Regel nicht der Fall ist. Dieser schwankende "ungebundene" Anteil der Donor-Moleküle führt zu einer beträchtlichen Unsicherheit bei der gemessenen FRET-Effizienz, was Vergleiche zwischen Experimenten unmöglich macht. Mit FRET-FLIM wird dieser Nachteil überwunden.
Wie bereits erwähnt, wird die FRET-Effizienz aus dem Verhältnis der Fretting-Donor-Lebensdauer, τquench, zur Nicht-Fretting-Lebensdauer, τ, berechnet:
Voraussetzung für eine präzise Messung muss τ durch eine Prüfung mit einer Probe bekannt sein, die nur den Donor enthält. Wichtig ist, jegliche Emission des Akzeptors auszuschließen. Sowohl für die Messung nur mit dem Donor als auch für die Messung mit der FRET-Probe müssen dieselben Einstellungen verwendet werden.
Lösung für FLIM-FRET
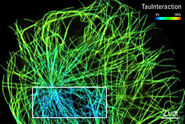
Führen Sie FLIM-FRET-Messungen effizient mit dem STELLARIS 8 FALCON-System durch. Es bietet eine integrierte FRET-Analyse. TauInteraction ist das TauSense-Tool der STELLARIS-Plattform, das bei FRET-Experimenten den minimalen Anteil an interagierenden Donoren liefert [3].