Was ist Kryo-Elektronen-Tomographie?
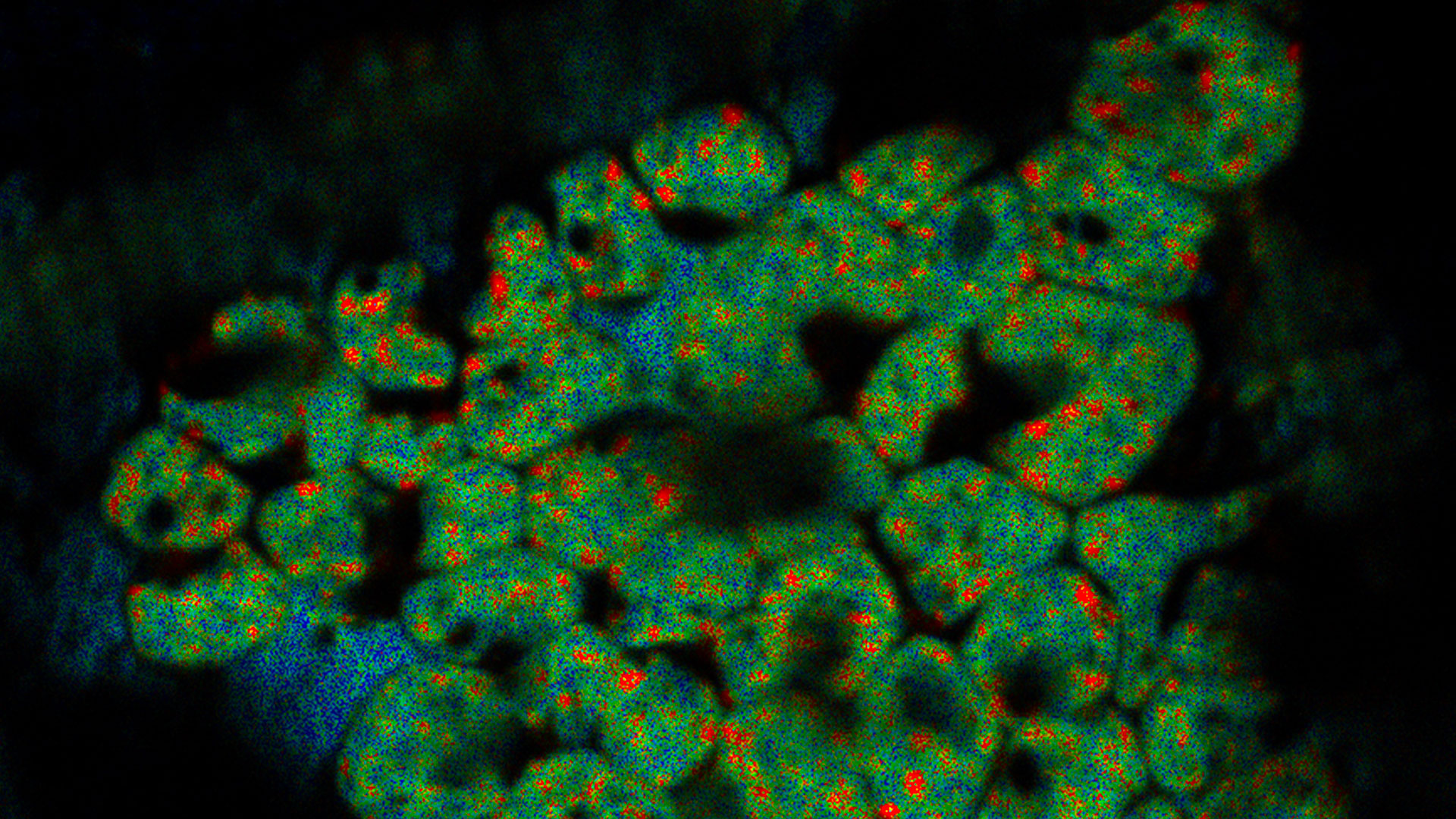
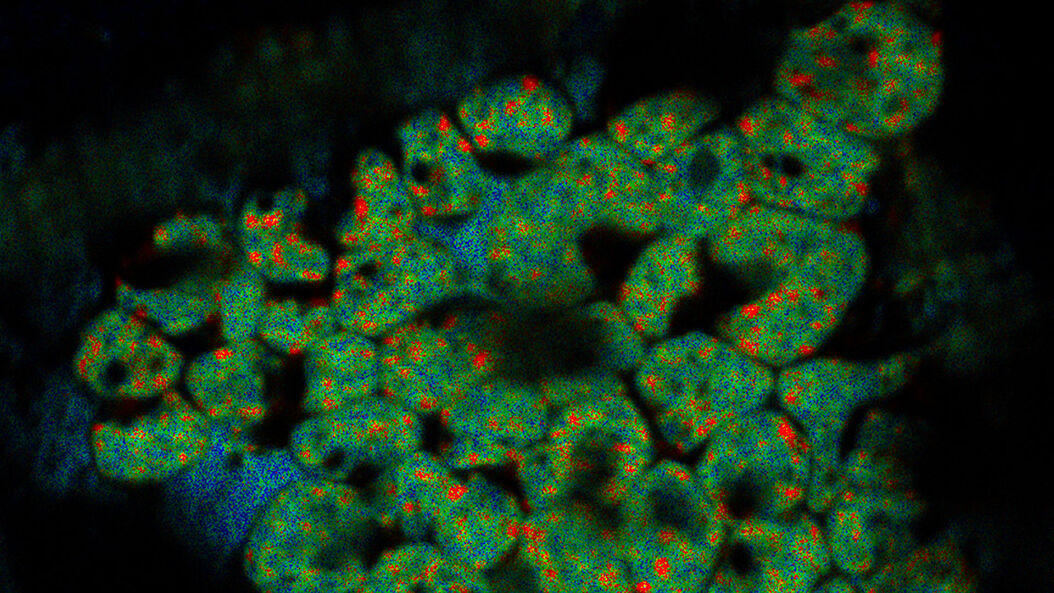
Die Kryo-Elektronen-Tomographie (auch Elektronen-Kryotomographie genannt) ermöglicht die Analyse von Protein-Protein-Interaktionen in dreidimensionaler molekularer Auflösung im nativen und funktionellen Zustand. Die Probe wird mit einer zweidimensionalen Bilderserie aufgenommen, während sie gelichzeitig in kontrolliert verkippt wird. Die resultierenden „Bild-Schichten“ können dann kombiniert werden, um eine 3D-Rekonstruktion der Probe zu erstellen.
Verwandte Artikel
The Cryo-CLEM Journey
New Imaging Tools for Cryo-Light Microscopy
Improve Cryo Electron Tomography Workflow
Was sind die Schritte in einem CryoET-Workflow?
Die Technik umfasst die Vorbereitung von Proben auf Elektronenmikroskopienetzchen, die anschließend schnell in flüssiges Ethan getaucht werden, um die Probe zu vitrifizieren um die Bildung von Eiskristallen zu verhindern.
Zur Durchführung einer hochauflösenden Kryotomographie sollte die abgebildete Schichtdicke der Probe nicht größer als 300 nm sein. Zur Beobachtung „dickerer“ Teile der Proben, wie Zellkörper, muss die Probe gedünnt werden. Neben der Kryo-Ultramikrotomie ist das Abtragen der Probe mit einem fukosierten Ionenfeinstrahl (FIB) in einem speziellen Kryo-Raster-Elektronenmikroskop die Methode der Wahl. Zwei Ionenstrahlfenster sind so positioniert, dass im interessierenden Bereich eine dünnes Eisscheibe (Lamelle) von ca. 200 nm Dicke entsteht, um ihn für Cryo ET zugänglich zu machen.
Die vorbereiteten Proben können nun mit dem Kryotransmissionselektronenmikroskop gescannt werden. Danach muss der Datenrekonstruktionsprozess stattfinden, um die 2D-Bilder in einem einzigen 3D-Modell zu rekonstruieren.
Was sind die Herausforderungen in einem typischen CryoET-Workflow?
Die größte Herausforderung, die mit einem typischen CryoET-Workflow verbunden ist, liegt in der Schwierigkeit, den genauen Untersuchungsbereich zu identifizieren, der die zu abzubildende Zelle oder das abzubildende Protein enthält. Wiederholte Fehler bei der Zielerfassung können zu mehreren Wiederholungen eines zeitaufwändigen Prozesses führen, was letztendlich eine Verschwendung kostspieliger Bildgebungszeit am Elektronenmikroskop (EM) darstellt. Zwei weitere Herausforderungen im Arbeitsablauf bestehen darin, sicherzustellen, dass die Probenqualität und Eisdicke durchgehend konsistent sind, und die Proben ausreichend vitrifiziert bleiben, bevor sie in das Kryo-TEM übertragen werden.
Wie können die Herausforderungen von CryoET mit Hilfe der Kryolichtmikroskopie gemeistert werden?
Die Kryolichtmikroskopie kann in zweierlei Hinsicht einen positiven Beitrag zum CryoET-Workflow leisten.
Erstens hilft die Lichtmikroskopie, die Qualität der Probe zu beurteilen. Das Kryolichtmikroskop gibt einen schnellen Überblick über die Gefrierqualität und Eisdicke der Probe sowie darüber, ob die Probenverteilung für die weitere Verarbeitung optimal ist. Die Kryolösungen von Leica sorgen dafür, dass die Proben während dieser Schritte sicher und nutzbar bleiben.
Zweitens besteht das größte Potenzial des Kryolichtmikroskops darin, eine höhere Workflow-Effizienz zu ermöglichen, indem die Struktur von Interesse viel präziser anzuvisiert werden kann, bevor die zeit- und kostenintensiven CryoEM-Vorbereitungen beginnen. Die Kryolichtmikroskopielösungen von Leica ermöglichen den Bild- und Koordinatenexport der Zielstruktur in die nachfolgenden EM-Schritte, wodurch die EM-Bildgebungszeit erheblich reduziert wird.

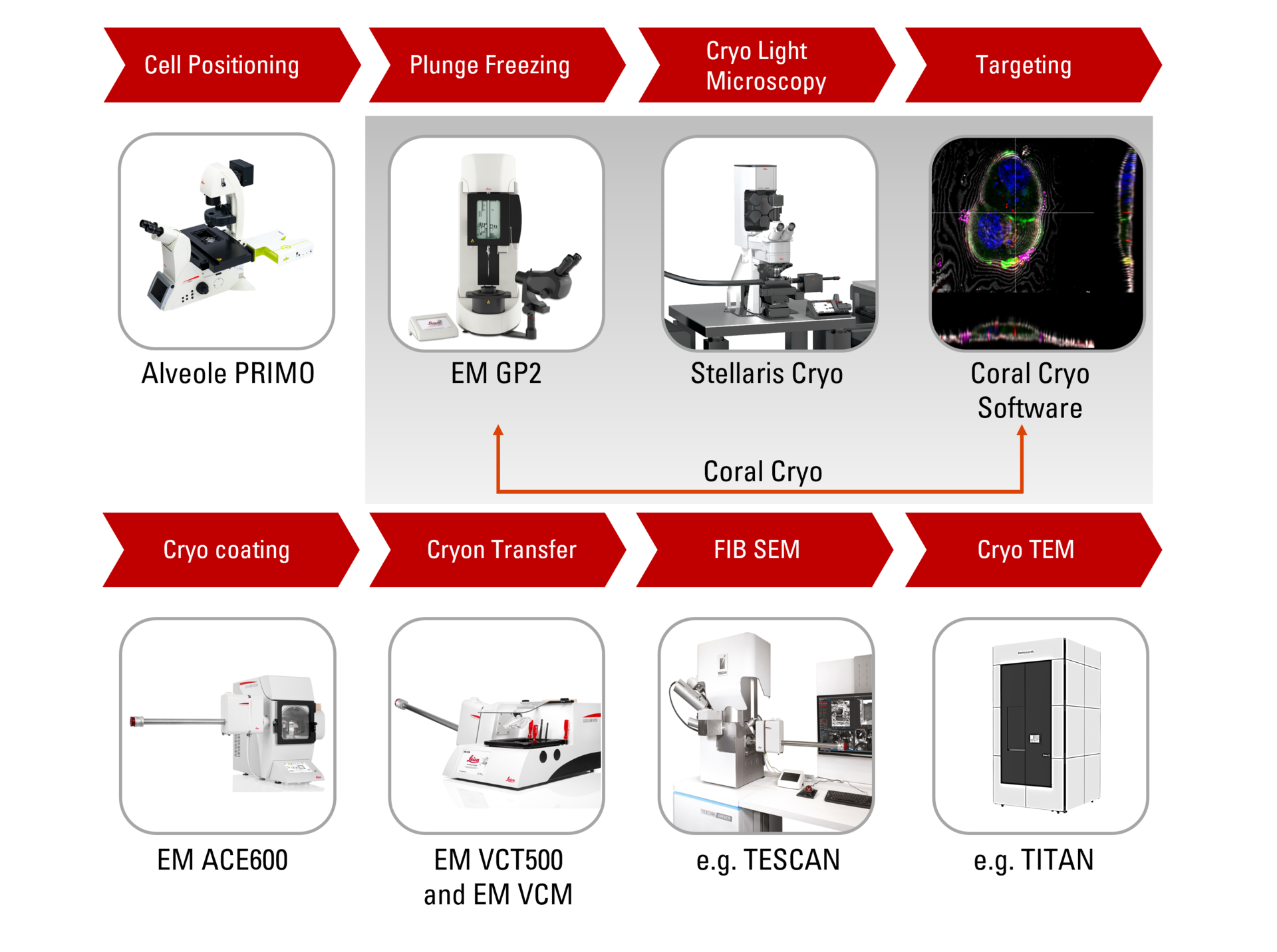
Coral Cryo: der effektive CryoET-Workflow
Die speziellen 3D-Kryo-Elektrotomographie-Workflow-Lösungen von Leica meistern typische Herausforderungen, indem sie die Lebensfähigkeit von Proben, Qualitätsprüfungen und vor allem einen präzisen und zuverlässigen 3D-Zielmechanismus sicherstellen. Nutzen Sie unsere optimierte Hardware, einschließlich Kryo-Tisch und Shuttle, in Verbindung mit modernster CryoET-Targeting-Software sowie eine Vielzahl von nahtlosen Integrations- und Transferoptionen zu Kryo-FIB- oder VCT-Tischen.
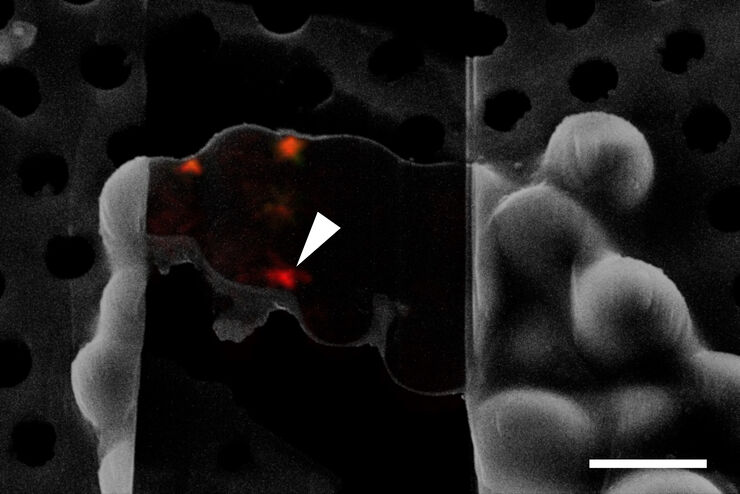
Präzises 3D-Volumen-Targeting ermöglichen
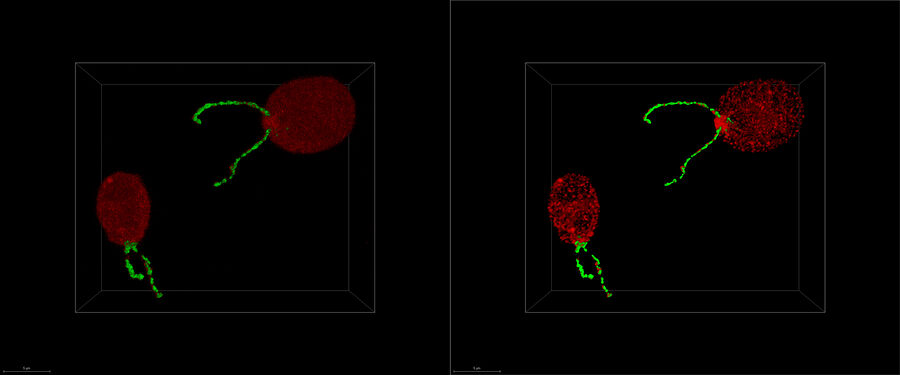
Erfahren Sie, wie der nahtlose Cryo-Electron Tomography Workflow Coral Cryo von Leica Microsystems mithilfe konfokaler Superauflösung Ihre Zielstrukturen präziser erfasst. Der Arbeitsablauf reduziert und optimiert die Anzahl der Arbeitsablaufschritte, verbessert die Probenaufnahme und -übertragung und erhöht so die Produktivität des CryoET-Arbeitsablaufs.
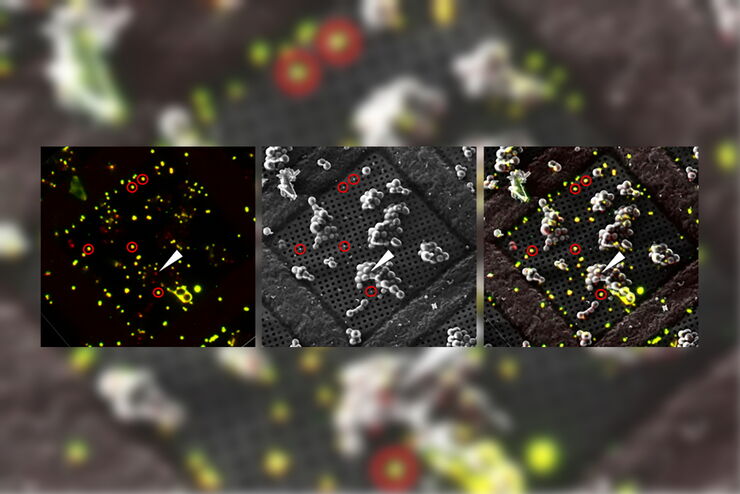
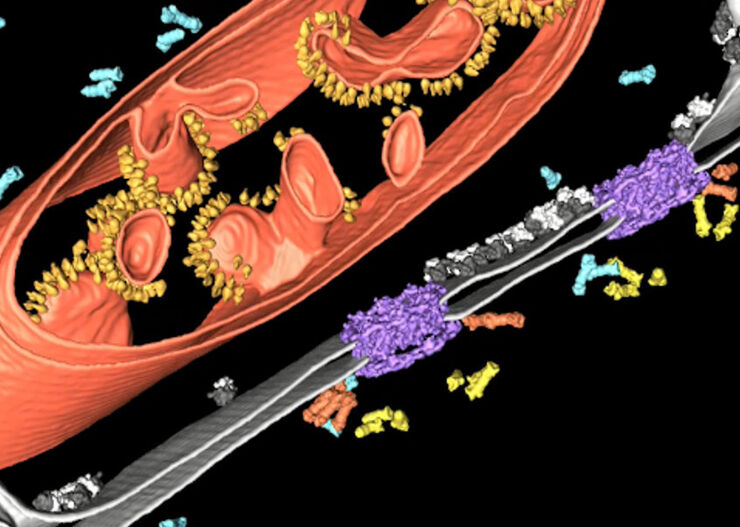
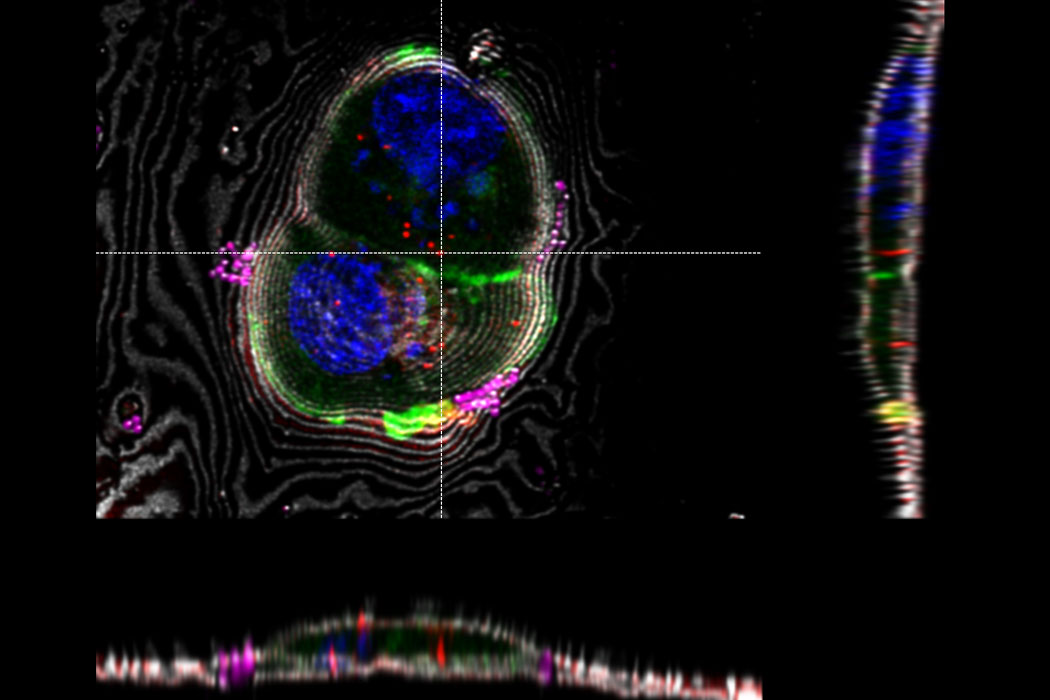
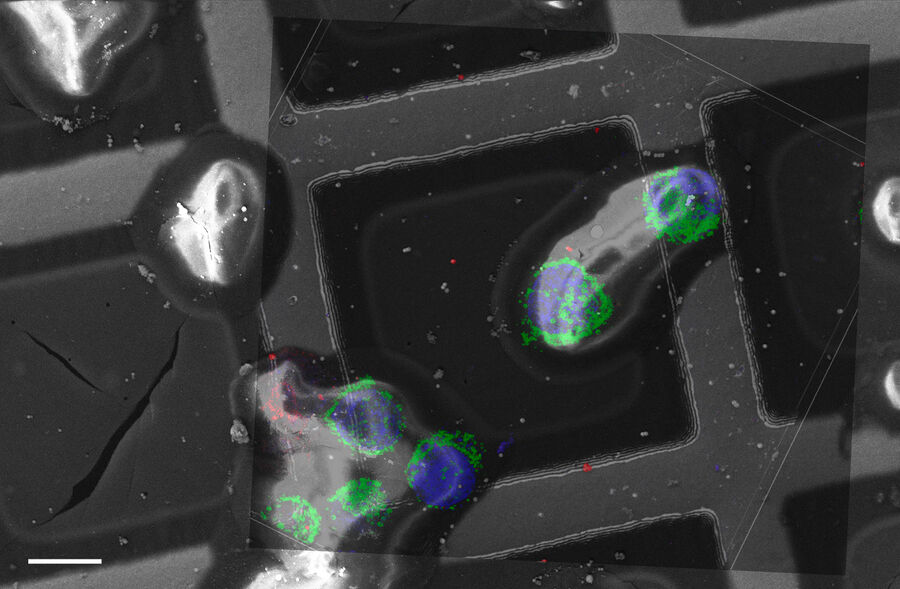
Überlagerung eines superaufgelösten konfokalen 3D-Bildes mit der oberen SEM-Ansicht (linke Ansicht) und der FIB-Ansicht (rechte Ansicht). Die Überlagerung erfolgte anhand der Mikrokugeln als Orientierungspunkte für die Korrelation. HeLa-Zellen wie folgt gekennzeichnet: Kerne von Hoechst, blau; Mitochondrien von MitoTracker Green, grün; Lipidtröpfchen mit Bodipy und purpurrote Mikrokugeln, rot). Messskala: 20 µm. Zellen freundicherweise von Ievgeniia Zagoriy und SEM/FIB-Bilder freundlicherweise von Herman Fung, Mahamid-Group, EMBL-Heidelberg, Deutschland, bereitgestellt.
Verwandte Artikel
How to Target Fluorescent Structures in 3D for Cryo-FIB Milling
Targeting Active Recycling Nuclear Pore Complexes using Cryo Confocal Microscopy
Advancing Cell Biology with Cryo-Correlative Microscopy
Workflows and Instrumentation for Cryo-electron Microscopy
Auswahl: Kryo-Weitfeld oder Kryo-Konfokal?
Merkmale | Konfokal | THUNDER (Weitfeld) |
|---|---|---|
| Empfindlichkeit | * | |
| Geschwindigkeit | * | |
| Laterale Auflösung | ** | * |
| Axiale Auflösung | ** | * |
| Optimierung der Anregung und Emission von Farbstoffen für kryogene Bildgebungsbedingungen | ** | * |
| Unterdrückung der Autofluoreszenz (Probe oder Kohlenstoffschicht) | * | |
| Targeting und Export | 3D | 2D |