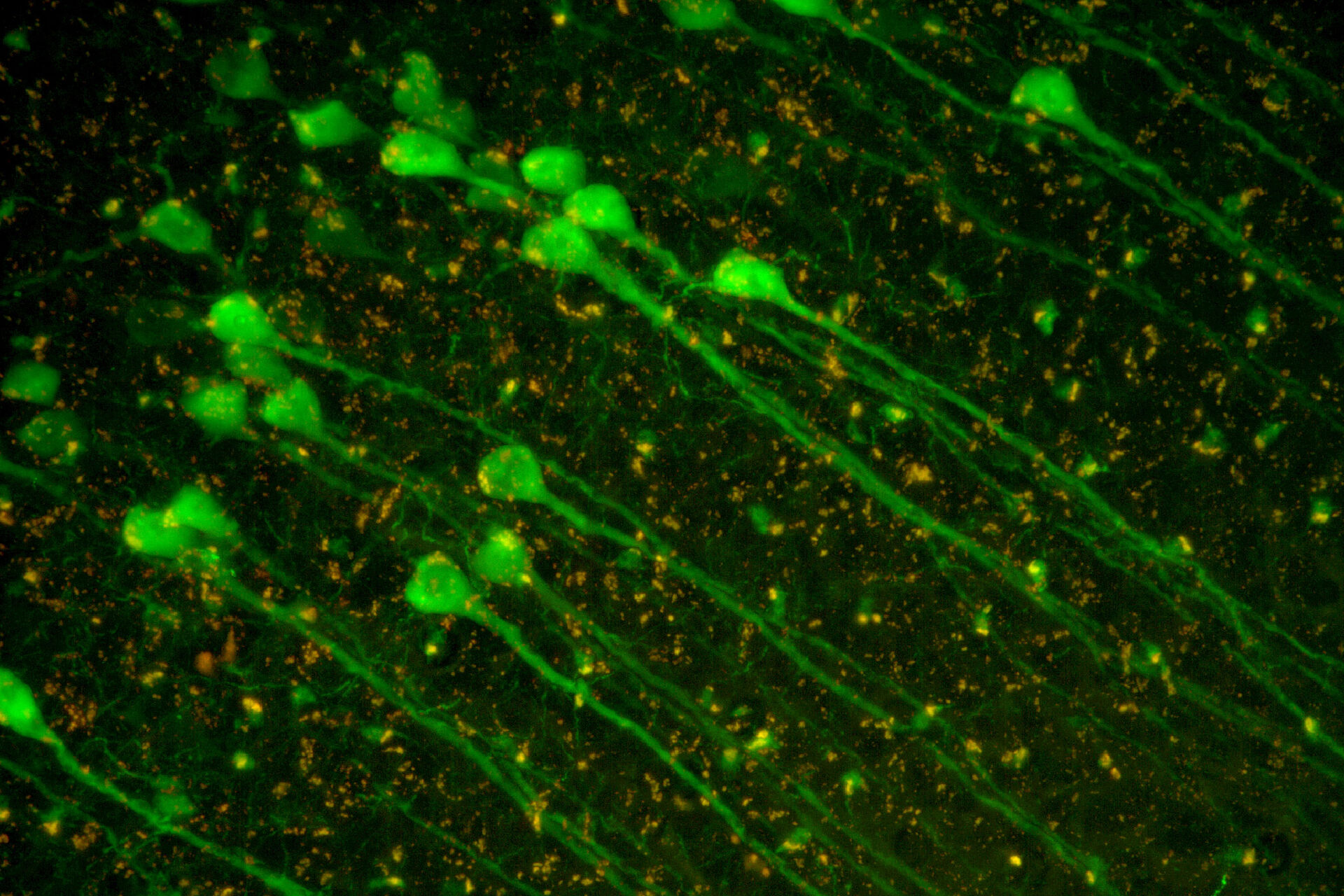
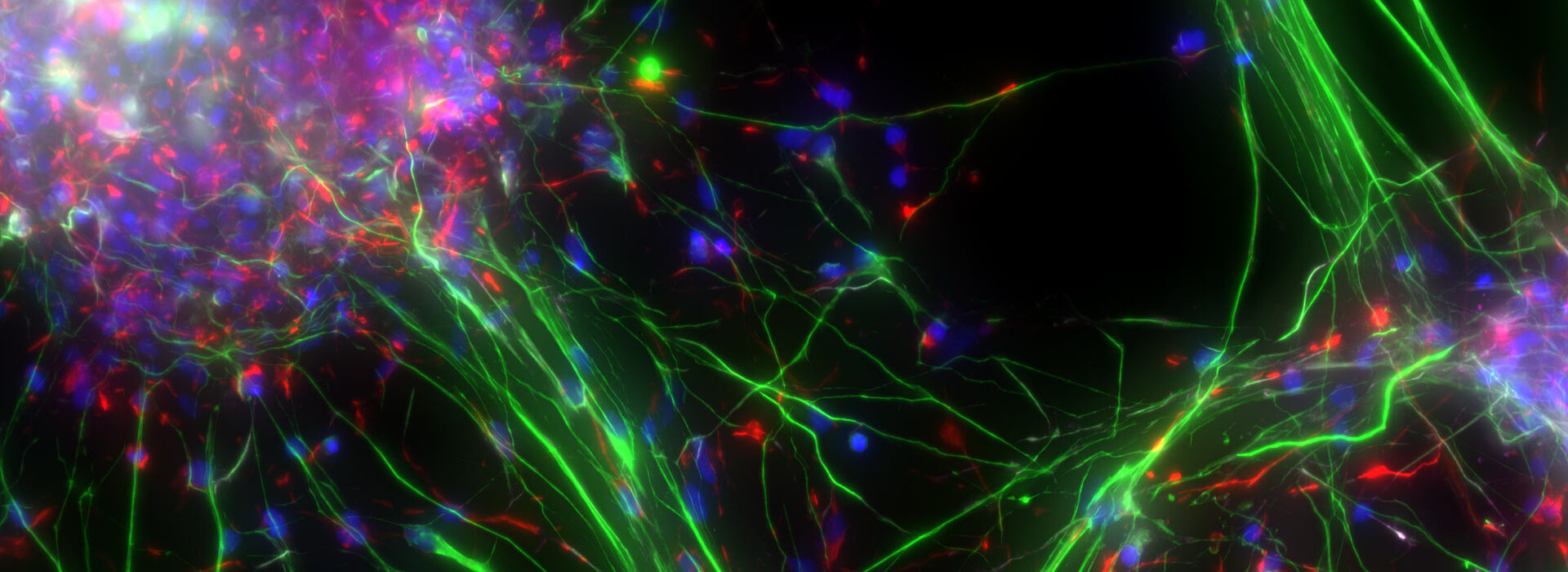
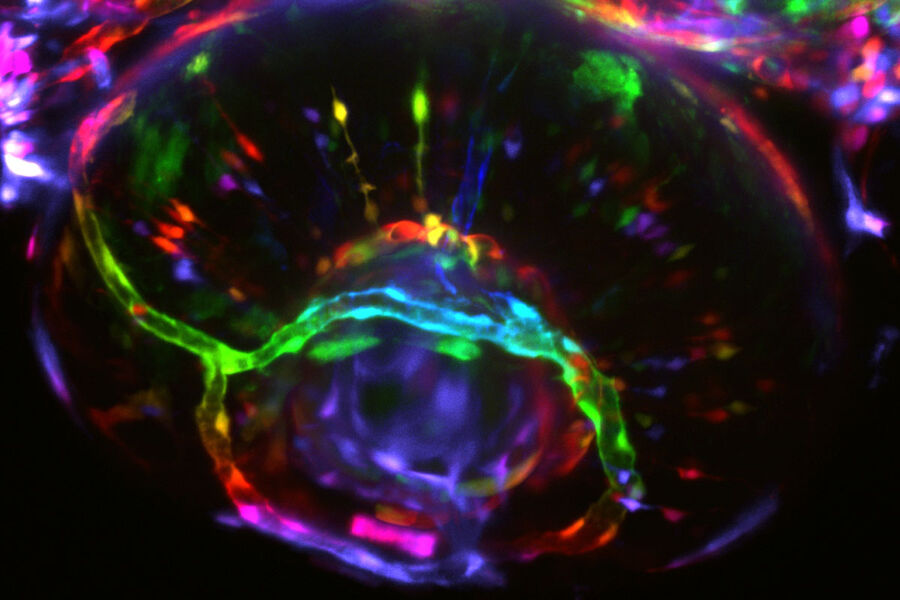
Neurowissenschaftliche Forschung
Neurowissenschaften sind ein multidisziplinäres Gebiet, in dem Struktur und Funktion des Nervensystems untersucht werden. Ziel ist es, die Entwicklung kognitiver und Verhaltensprozesse zu verstehen sowie Erkrankungen wie Alzheimer oder Parkinson zu verstehen und Therapien für sie zu finden.
Der Einsatz von Mikroskopietechniken ist entscheidend, um das Nervensystem auf zellulärer und subzellulärer Ebene zu visualisieren und molekulare Veränderungen im zellulären Kontext zu betrachten. Neueste Entwicklungen bei der Bildgebung in großer Tiefe haben weitere Einblicke in die neuronalen Funktionen geliefert. Neue Technologien wie die Markierung genetischer Zellen und die Optogenetik ergänzen diese Entwicklungen.
Unsere Experten für Lösungen im Bereich Neurowissenschaften beraten Sie gern
Herausforderungen bei der Bildgebung in der neurowissenschaftlichen Forschung
Die Erforschung des Nervensystems erfordert häufig die Kombination von hoher Auflösung, tiefer Bildgebung und Visualisierung großer Schnitte. Sie benötigen auch Flexibilität, um verschiedene Arten von Proben abzubilden, z. B. lebende Zellen, Gewebe, Organoide und Modellorganismen.
Die Untersuchung schneller dynamischer Prozesse wie Zelltransport oder synaptisches Remodelling erfordert den Einsatz von Hochgeschwindigkeitsmikroskopie. Eine der größten Herausforderungen der Hochgeschwindigkeitsmikroskopie besteht darin, hochauflösende Bilder zu erfassen und gleichzeitig eine Fluoreszenzsättigung zu vermeiden.
Die neurowissenschaftliche Forschung umfasst häufig die großflächige und volumetrische Bildgebung. Die Notwendigkeit, die Fluoreszenzstreuung und das Hintergrundsignal zu reduzieren, kann die Erfassung von Bildern mit hohem Kontrast und hoher Auflösung erschweren, die jedoch besonders wichtig sind, wenn die neuronale Architektur in dichten Geweben wie Hirnschnitten untersucht wird.
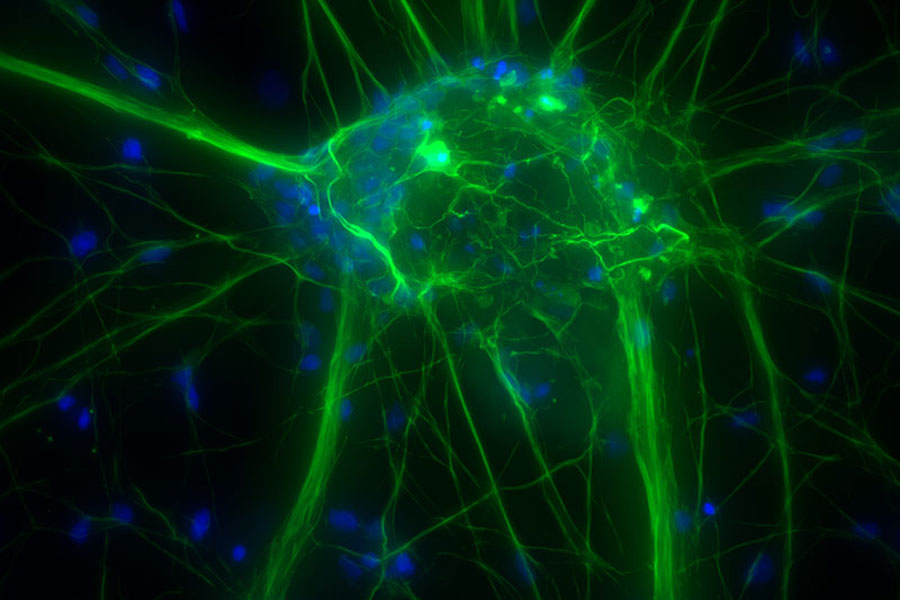
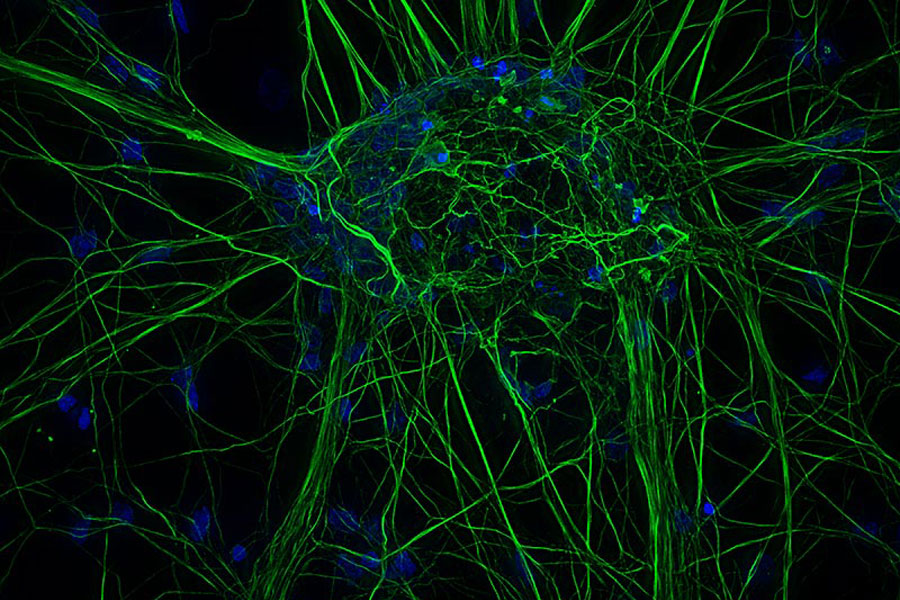
Kultivierte kortikale Neuronen. Z-Stapel von 59 Ebenen (Dicke: 21 µm). Probe zur Verfügung gestellt von FAN GmbH, Magdeburg.
Mikroskopiemethoden für die neurowissenschaftliche Forschung
Die Untersuchung des Nervensystems beruht typischerweise auf konfokaler Mikroskopie zur hochauflösenden Abbildung von Ereignissen und Strukturen. Für eine tiefere in vivo-Bildgebung wird die Multiphotonenmikroskopie verwendet, da ihre Fähigkeit zur Verwendung einer Anregung im nahen Infrarotbereich die Lichtstreuung verringert und eine tiefe Bildgebung mit minimaler Invasivität ermöglicht. Lichtblattmikroskopie wird auch für lichtempfindliche oder 3D-Proben bevorzugt. Sie verringert die Phototoxizität und bietet intrinsische optische Schnitte und 3D-Bildgebung.
- Optogenetik ist eine Methode, bei der die neuronale Aktivität mithilfe von Licht gesteuert wird, was die Untersuchung spezifischer neuronaler Netzwerke und der Signalübertragung von Zellen ermöglicht. Sie erfordert die Expression von lichtempfindlichen Proteinen in der neuronalen Zellmembran. Die Untersuchung von Ereignissen im Nanobereich mithilfe der Optogenetik in Kombination mit einer im Millisekundenbereich zeitgesteuerten Präzisionsverglasung ist eine vielversprechende Technologie, um bestimmte Zeitpunkte innerhalb eines dynamischen Prozesses zu untersuchen.
- Elektrophysiologie ist die Untersuchung der elektrischen Eigenschaften von Geweben und Zellen und umfasst die Untersuchung der elektrischen Eigenschaften von Neuronen. Die Funktion von Nerven- und Muskelzellen beruht auf Ionenströmen, die durch Ionenkanäle fließen. Eine Möglichkeit zur Untersuchung von Ionenkanälen ist die Patch Clamp Technik Diese Methode ermöglicht die detaillierte Untersuchung von Ionenkanälen und die Aufzeichnung der elektrischen Aktivität verschiedener Zelltypen, hauptsächlich erregbarer Zellen wie Neuronen.
THUNDER Imager
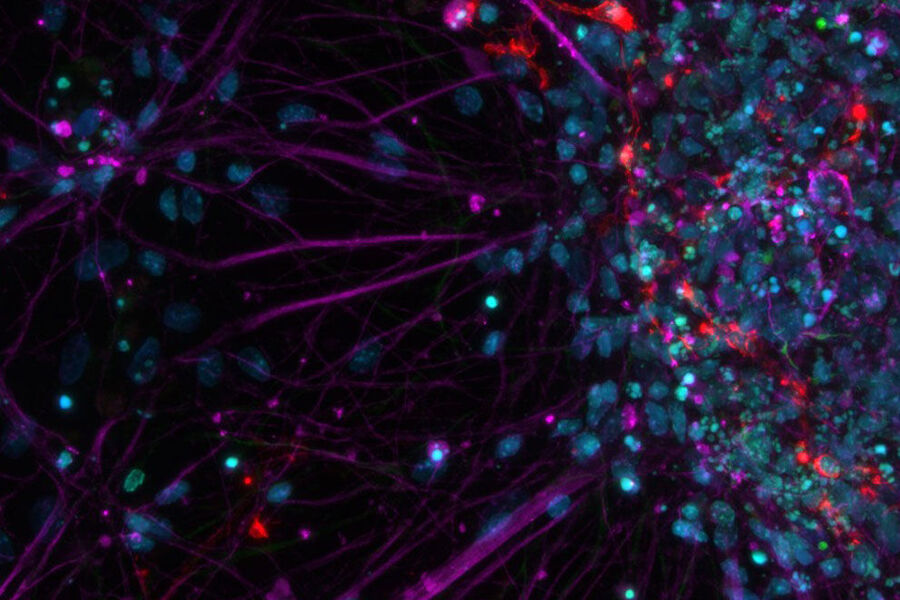
Mit THUNDER Imagern erhalten Sie in Echtzeit eine klare Sicht auf Details, auch tief in einer intakten Probe, ohne Unschärfen. Ihre Fähigkeit, scharfe Bilder aufzunehmen, verändert Ihre Arbeitsweise grundlegend, wenn Sie Modellorganismen, Gewebeschnitte und 3D-Zellkulturen wie Organoide abbilden. Sie können dickere Schnitte verwenden und größere Strukturen abbilden als mit einem üblichen Weitfeldmikroskop.
SP8 DIVE (Deep In Vivo Explorer)
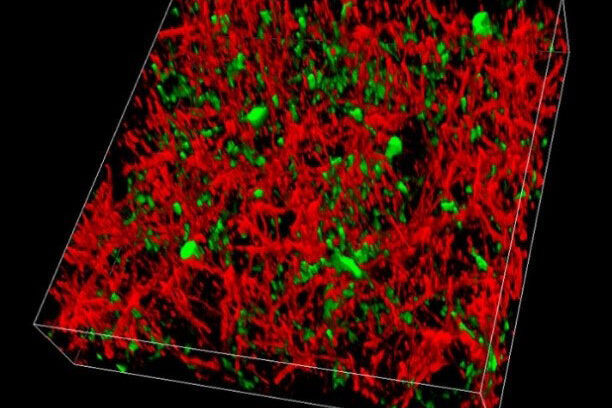
SP8 DIVE (Deep In Vivo Explorer) ist das erste Multiphotonenmikroskop mit spektral einstellbarer Detektion. Es bietet maximale Eindringtiefe und Kontrast für eine tiefe in vivo-Bildgebung. Mit dem SP8 DIVE können Sie tiefste Einblicke und feinste Details einstellen und gleichzeitig mehrere Marker mit perfekter Farbseparation abbilden. Aufgrund seiner hohen Präzision und Empfindlichkeit eignet es sich perfekt für die Abbildung lebender Neuronen.
Mica
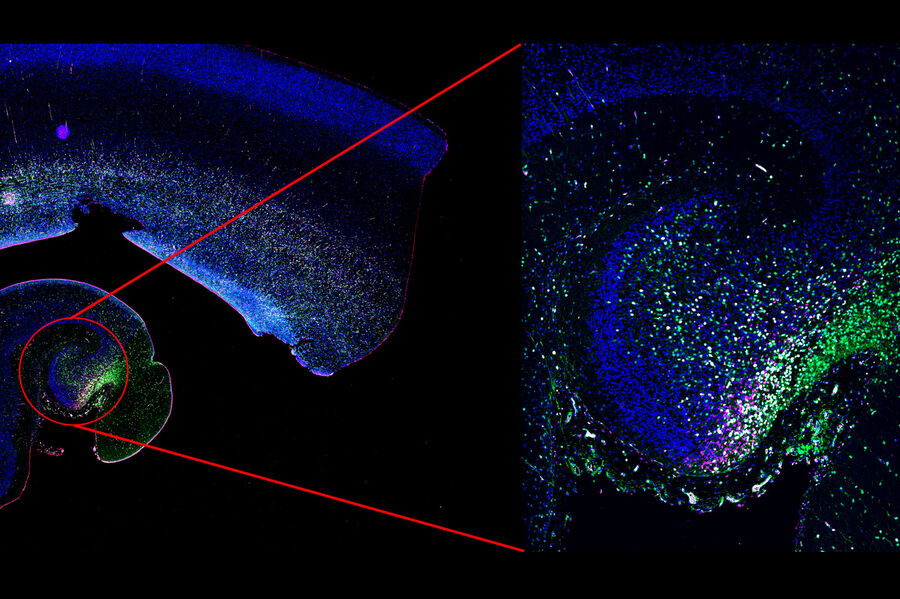
Mica, der weltweit erste Microhub, vereint Weitfeld- und Konfokal-Bildgebung mit KI-gestützter Analyse. Alles vereint in einer probenschonenden Inkubatorumgebung. Mica ist schnell und einfach zu bedienen und ermöglicht Ihnen dank der FluoSync™-Technologie die simultane Visualisierung von bis zu 4 Labels im Weitfeld- oder Konfokalmodus. Jetzt können Sie viermal mehr Daten mit 100 % raumzeitlicher Korrelation generieren und von Weitfeld auf Konfokal umschalten, ohne Ihre Probe zu bewegen.
Möchten Sie mehr erfahren?
Sprechen Sie mit unseren Experten.
Wünschen Sie eine persönliche Beratung? Show local contacts